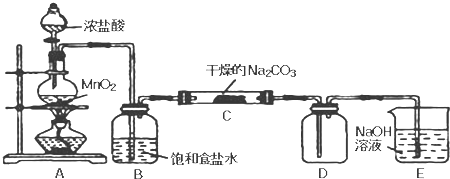
题目内容
弱电解质电离要吸收热量.分别用40克氢氧化钠和盐酸、醋酸完全反应,放出的热量( )
| A、前者大于后者 | B、相等 |
| C、前者小于后者 | D、无法判断 |
考点:反应热和焓变,弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:酸碱中和为放热反应,如电解质完全电离,则放出的热量相等,但醋酸为弱酸,电离吸热,放出的热量较盐酸少.
解答:
解:醋酸和氢氧化钠中和反应中,要先电离,为吸热过程,然后发生中和反应为放热过程,而氢氧化钠与盐酸反应,只放出热量,
则盐酸与氢氧化钠反应放出的热量较多,
故选A.
则盐酸与氢氧化钠反应放出的热量较多,
故选A.
点评:本题考查弱电解质的电离以及反应热与焓变等知识,综合考查学生的科学素养,难度不大,注意相关基础知识的积累.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
下列选项中的哪种物质可以与氧化铁在高温下发生铝热反应( )
| A、焦炭 | B、一氧化碳 |
| C、氧化铝 | D、金属铝粉 |
体积相同的甲、乙两个容器,分别都充等量的SO2和O2,在相同温度下发生反应:2SO2(g)+O2(g)?2SO3(g) 并达到平衡,在此过程中,甲维持容器的体积不变,乙维持容器的压强不变,若甲中SO2的转化率为a%,则对乙中SO2的转化率的合理描述为( )
| A、大于a% | B、等于a% |
| C、小于a% | D、无法判断 |
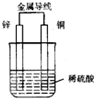
如图为原电池示意图,下列说法中正确的是( )


| A、锌片是正极 |
| B、铜片是负极 |
| C、电子由锌片通过导线流向铜片 |
| D、该装置能够将电能转化为化学能 |
下列现象与胶体知识无关的是( )
| A、日常生活中看到的云、烟、雾 |
| B、向豆浆中加入石膏制得可口的豆腐 |
| C、蒸发饱和食盐水析出氯化钠晶体 |
| D、向沸水中逐滴加入饱和的FeCl3溶液,得到红褐色透明的分散系 |
阿伏加德罗常数用NA表示,下列叙述正确的是( )
| A、常温常压下,1 mol NO2中含有的分子数为 NA |
| B、常温常压下,0.2mol铁在0.2 mol氯气中充分燃烧,转移的电子数为 0.6NA |
| C、7.8g过氧化钠粉末与足量二氧化硫反应转移的电子数为0.2NA |
| D、11.2L Cl2通入足量氢氧化钠溶液中充分反应,转移的电子数为0.5NA |
下列离子方程式正确的是( )
| A、碳酸钙和盐酸反应:CO32-+2H+═H2O+CO2↑ |
| B、向硝酸银溶液中加盐酸:Ag++C1-═AgCl↓ |
| C、向稀盐酸溶液中加铁:3Fe+6H+═3Fe3++3H2↑ |
| D、向氢氧化钡溶液中加硫酸溶液:Ba2++SO42-═BaSO4↓ |
 如图是铜锌原电池,某同学做完实验后记录如下:
如图是铜锌原电池,某同学做完实验后记录如下: