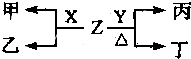题目内容
下列离子中,核外有10个电子的是( )
| A、Mg2+ |
| B、S2- |
| C、K+ |
| D、Cl- |
考点:原子构成
专题:原子组成与结构专题
分析:依据原子与离子的关系,得出Mg2+表示带2个单位的正电荷,即镁原子失去2个电子,镁原子带12个电子,故Mg2+带10个电子,据此依次分析,选择即可.
解答:
解:A、Mg2+表示带2个单位的正电荷,即镁原子失去2个电子,镁原子带12个电子,故Mg2+带10个电子,故A正确;
B、S2-表示带2个单位的负电荷,即硫原子得到2个电子,硫原子带16个电子,故该离子带18个电子,故B错误;
C、K+表示带1个单位的正电荷,即钾原子失去1个电子,钾原子带19个电子,故该离子带18个电子,故C错误;
D、Cl-表示带1个单位的负电荷,即氯原子得到1个电子,氯原子带17个电子,故该离子带18个电子,故D错误,
故选A.
B、S2-表示带2个单位的负电荷,即硫原子得到2个电子,硫原子带16个电子,故该离子带18个电子,故B错误;
C、K+表示带1个单位的正电荷,即钾原子失去1个电子,钾原子带19个电子,故该离子带18个电子,故C错误;
D、Cl-表示带1个单位的负电荷,即氯原子得到1个电子,氯原子带17个电子,故该离子带18个电子,故D错误,
故选A.
点评:本题主要考查的是离子符号的含义,明确阳离子与原子的关系以及阴离子与原子的关系是解决本题的关键,难度不大.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案
相关题目
下列有关仪器的使用,能实现的是 ( )
| A、用托盘天平称取11.7g食盐 |
| B、用量筒量取12.36ml盐酸 |
| C、用酸式滴定管量取21.20ml 0.10mol/L H2SO4溶液 |
| D、用200ml容量瓶配制500ml 0.1mol/L NaCl溶液 |
某氨水的pH=a,其中水的电离度为α1;某硝酸的pH=b,其中水的电离度为α2;已知a+b=14,a>11.将氨水与硝酸等体积混合后,所得溶液中水的电离度为α3.相同条件下纯水的电离度为α4.则下列关系中正确的是( )
| A、α3>α4>α2=α1 |
| B、α4>α3>α2=α1 |
| C、c(NO3-)>c(NH4+)>c(OH-)>c(H+) |
| D、c(NO3-)>c(NH4+)>c(H+)>c(OH-) |
以下结构简式表示一种有机物的结构,关于其性质的叙述不正确的是( )
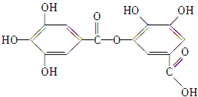

| A、它有酸性,能与纯碱溶液反应 |
| B、可以水解,其水解产物只有一种 |
| C、1 mol该有机物最多能与7 mol NaOH反应 |
| D、该有机物能发生取代反应 |
平衡体系H2CO3?H++HCO3-,HCO3-?H++CO32- 中,溶液中c(OH-)增大时c(CO32-)将( )
| A、增大 | B、减少 |
| C、不变 | D、可能增大也可能减少 |
下列说法中不正确的是( )
| A、蓄电池在放电过程中,负极质量增加,正极质量也增加 |
| B、电解法是最强有力的氧化还原手段,可以将极难还原的活泼金属从它们的化合物中还原出来 |
| C、钢铁发生吸氧腐蚀时,负极反应式为:Fe-3e-═Fe3+ |
| D、电解精炼铜时,用纯铜板作阴极,粗铜板作阳极,用硫酸铜溶液作电解液 |
 由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀,若用如图所示实验装置可制得纯净的Fe(OH)2沉淀.两极材料分别为石墨和铁.
由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀,若用如图所示实验装置可制得纯净的Fe(OH)2沉淀.两极材料分别为石墨和铁.