题目内容
A、B、C三种短周期元素在周期表中相对位置如图:
(1)A与C形成的液态化合物是常见的重要有机溶剂,则A、B、C三种元素最高价氧化物对应的水化物酸性由强到弱的顺序是: > > (用化学式表示).
(2)X、Y为B、C两种元素形成的单质,标准状况下,X的密度为3.17g?L-1.Z是一种化合物,焰色反应呈紫色(透过蓝色钴玻璃),室温下0.1mol?L-1Z水溶液pH=13.X、Y、Z有如图转化关系:
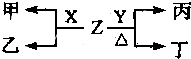
①写出X与Z反应的离子方程式: .
②已知丙能与稀硫酸反应生成能使品红褪色的气体.丁的化学式为 ,丁的水溶液pH>7的原因是: (用离子方程式表示).
③将20mL0.5mol/L丙溶液逐滴加入20mL0.2mol/L KMnO4溶液(硫酸酸化)中,恰好褪色.写出反应的离子方程式 .
| A | |||
| B | C |
(2)X、Y为B、C两种元素形成的单质,标准状况下,X的密度为3.17g?L-1.Z是一种化合物,焰色反应呈紫色(透过蓝色钴玻璃),室温下0.1mol?L-1Z水溶液pH=13.X、Y、Z有如图转化关系:
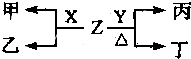
①写出X与Z反应的离子方程式:
②已知丙能与稀硫酸反应生成能使品红褪色的气体.丁的化学式为
③将20mL0.5mol/L丙溶液逐滴加入20mL0.2mol/L KMnO4溶液(硫酸酸化)中,恰好褪色.写出反应的离子方程式
考点:元素周期律和元素周期表的综合应用,无机物的推断
专题:
分析:(1)短周期元素A与C形成的液态化合物是常见的重要有机溶剂,则A为C,C为Cl,B为S,非金属性越强,最高价氧化物对应水化物的酸性就越强;
(2)单质X、Y分别由C、B两种元素形成.标准状况下,X的密度为3.17g/L,X相对分子质量=3.17×22.4=71,故X为Cl2、Y为硫,Z是一种强碱,焰色反应呈紫色(透过蓝色钴玻璃),则Z为KOH,
①氯气与氢氧化钾反应是氯化钾、次氯酸钾与水;
②丙能与稀硫酸反应生成能使品红褪色的气体,则丙为亚硫酸钠、丁为硫化钾,为强碱弱酸盐水解呈碱性;
③将20mL0.5mol/LNa2SO3溶液逐滴加入20mL0.2mol/L KMnO4溶液(硫酸酸化)中,恰好褪色,亚硫酸根被氧化物为硫酸根,令Mn元素在还原产物中的化合价为x,则有电子转移守恒:0.02×0.5×(6-4)=0.02×0.2×(7-x),解得x=2,故生成Mn2+,据此书写离子方程式;
(2)单质X、Y分别由C、B两种元素形成.标准状况下,X的密度为3.17g/L,X相对分子质量=3.17×22.4=71,故X为Cl2、Y为硫,Z是一种强碱,焰色反应呈紫色(透过蓝色钴玻璃),则Z为KOH,
①氯气与氢氧化钾反应是氯化钾、次氯酸钾与水;
②丙能与稀硫酸反应生成能使品红褪色的气体,则丙为亚硫酸钠、丁为硫化钾,为强碱弱酸盐水解呈碱性;
③将20mL0.5mol/LNa2SO3溶液逐滴加入20mL0.2mol/L KMnO4溶液(硫酸酸化)中,恰好褪色,亚硫酸根被氧化物为硫酸根,令Mn元素在还原产物中的化合价为x,则有电子转移守恒:0.02×0.5×(6-4)=0.02×0.2×(7-x),解得x=2,故生成Mn2+,据此书写离子方程式;
解答:
解:(1)短周期元素A与C形成的液态化合物是常见的重要有机溶剂,则A为C,C为Cl,B为S,非金属性Cl>S>C,则元素最高价氧化物对应的水化物酸性由强到弱的顺序为HClO4>H2SO4>H2CO3,
故答案为:HClO4;H2SO4;H2CO3;
(2)单质X、Y分别由C、B两种元素形成.标准状况下,X的密度为3.17g/L,X相对分子质量=3.17×22.4=71,故X为Cl2、Y为硫,Z是一种强碱,焰色反应呈紫色(透过蓝色钴玻璃),则Z为KOH,
①氯气与氢氧化钾反应是氯化钾、次氯酸钾与水,反应离子方程式为:Cl2+2OH-═Cl-+ClO-+H2O,
故答案为:Cl2+2OH-═Cl-+ClO-+H2O;
②丙能与稀硫酸反应生成能使品红褪色的气体,则丙为亚硫酸钠、丁为硫化钾,为强碱弱酸盐,水解S2-+H2O?HS-+OH- 呈碱性,
故答案为:K2S;S2-+H2O?HS-+OH-;
③将20mL0.5mol/LNa2SO3溶液逐滴加入20mL0.2mol/L KMnO4溶液(硫酸酸化)中,恰好褪色,亚硫酸根被氧化物为硫酸根,令Mn元素在还原产物中的化合价为x,则有电子转移守恒:0.02×0.5×(6-4)=0.02×0.2×(7-x),解得x=2,故生成Mn2+,反应离子方程式为:5SO32-+2MnO4-+6H+═5SO42-+2Mn2++3H2O,
故答案为:5SO32-+2MnO4-+6H+═5SO42-+2Mn2++3H2O;
故答案为:HClO4;H2SO4;H2CO3;
(2)单质X、Y分别由C、B两种元素形成.标准状况下,X的密度为3.17g/L,X相对分子质量=3.17×22.4=71,故X为Cl2、Y为硫,Z是一种强碱,焰色反应呈紫色(透过蓝色钴玻璃),则Z为KOH,
①氯气与氢氧化钾反应是氯化钾、次氯酸钾与水,反应离子方程式为:Cl2+2OH-═Cl-+ClO-+H2O,
故答案为:Cl2+2OH-═Cl-+ClO-+H2O;
②丙能与稀硫酸反应生成能使品红褪色的气体,则丙为亚硫酸钠、丁为硫化钾,为强碱弱酸盐,水解S2-+H2O?HS-+OH- 呈碱性,
故答案为:K2S;S2-+H2O?HS-+OH-;
③将20mL0.5mol/LNa2SO3溶液逐滴加入20mL0.2mol/L KMnO4溶液(硫酸酸化)中,恰好褪色,亚硫酸根被氧化物为硫酸根,令Mn元素在还原产物中的化合价为x,则有电子转移守恒:0.02×0.5×(6-4)=0.02×0.2×(7-x),解得x=2,故生成Mn2+,反应离子方程式为:5SO32-+2MnO4-+6H+═5SO42-+2Mn2++3H2O,
故答案为:5SO32-+2MnO4-+6H+═5SO42-+2Mn2++3H2O;
点评:本题考查位置结构性质的关系、无机物推断、常用化学用语、氧化还原反应等,推断元素是解题关键,题目难度中等,需要学生熟练掌握元素化合物知识.

练习册系列答案
 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
对于某合成材料(如塑料制品)废弃物的处理方法中正确的是( )
| A、将废弃物混在垃圾中填埋在土壤中 |
| B、将废弃物焚烧 |
| C、将废弃物用化学方法加工成涂料或汽油 |
| D、将废弃物倾倒在海洋中 |
已知分子式为C10H14的分子,不能使溴水褪色,但可使酸化的高锰酸钾溶液褪色.它的分子结构中含有一个烷基,它与液溴在还原铁粉存在下,反应生成物结构有3种,则此烷基的结构有( )
| A、2种 | B、3种 | C、4种 | D、5种 |
下列离子中,核外有10个电子的是( )
| A、Mg2+ |
| B、S2- |
| C、K+ |
| D、Cl- |
常温下,下列溶液中酸性最弱的是( )
| A、pH=4 |
| B、[H+]=1×10-3 mol?L-1 |
| C、[OH-]=1×10-11 mol?L-1 |
| D、[H+]?[OH-]=1×10-14 |
升高温度,下列数据不一定增大的是( )
| A、化学反应速率v |
| B、弱电解质的电离平衡常数Ka |
| C、化学平衡常数K |
| D、水的离子积常数KW |
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.下列有关该电池设计的说法不正确的是( )
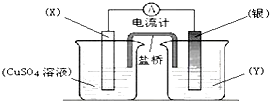

| A、电极X的材料是Cu |
| B、银电极为正极 |
| C、盐桥里Cl-移向电源的负极 |
| D、外电路中每通过0.2mol电子,银电极的质量理论上增加10.8g |
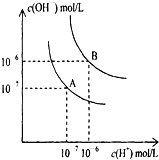 水的电离平衡曲线如图所示.
水的电离平衡曲线如图所示.