题目内容
下列说法中不正确的是( )
| A、蓄电池在放电过程中,负极质量增加,正极质量也增加 |
| B、电解法是最强有力的氧化还原手段,可以将极难还原的活泼金属从它们的化合物中还原出来 |
| C、钢铁发生吸氧腐蚀时,负极反应式为:Fe-3e-═Fe3+ |
| D、电解精炼铜时,用纯铜板作阴极,粗铜板作阳极,用硫酸铜溶液作电解液 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:A、铅蓄电池的负极是Pb单质反应,正极是PbO2反应,电解质溶液为硫酸,硫酸根能够与Pb2+反应生成沉淀;
B、原电池发生的是自发的氧化还原反应,电解池是强迫下的氧化还原反应;
C、钢铁发生吸氧腐蚀时,负极反应式为Fe-2e-═Fe2+;
D、根据电解原理分析,电解精炼铜粗铜做阳极,精铜做阴极,含铜离子的电解质溶液.
B、原电池发生的是自发的氧化还原反应,电解池是强迫下的氧化还原反应;
C、钢铁发生吸氧腐蚀时,负极反应式为Fe-2e-═Fe2+;
D、根据电解原理分析,电解精炼铜粗铜做阳极,精铜做阴极,含铜离子的电解质溶液.
解答:
解:A、铅蓄电池在放电过程中,正极和负极都会生成PbSO4沉淀,质量都会增大,故A正确;
B、电解池反应是外加电源强迫下的氧化还原反应,不能自发进行的氧化还原反应,通过电解的原理可以实现,可以将极难还原的活泼金属从它们的化合物中还原出来,故B正确;
C、钢铁发生吸氧腐蚀时,负极反应式为Fe-2e-═Fe2+,故C错误;
D、用电解法精炼粗铜时用纯铜作阴极,粗铜做阳极,含铜离子的电解质溶液,故D正确;
故选C.
B、电解池反应是外加电源强迫下的氧化还原反应,不能自发进行的氧化还原反应,通过电解的原理可以实现,可以将极难还原的活泼金属从它们的化合物中还原出来,故B正确;
C、钢铁发生吸氧腐蚀时,负极反应式为Fe-2e-═Fe2+,故C错误;
D、用电解法精炼粗铜时用纯铜作阴极,粗铜做阳极,含铜离子的电解质溶液,故D正确;
故选C.
点评:本题考查了铅蓄电池的电极反应、电解法制取金属、金属腐蚀、电解精炼铜,题目难度中等.

练习册系列答案
相关题目
下列离子中,核外有10个电子的是( )
| A、Mg2+ |
| B、S2- |
| C、K+ |
| D、Cl- |
升高温度,下列数据不一定增大的是( )
| A、化学反应速率v |
| B、弱电解质的电离平衡常数Ka |
| C、化学平衡常数K |
| D、水的离子积常数KW |
某校活动小组为探究金属腐蚀的相关原理,设计了如图a所示装置,图a的铁棒末段分别连上一块Zn片和Cu片,并静置于含有K3Fe(CN)6及酚酞的混合凝胶上.一段时间后发现凝胶的某些区域(如图b示)发生了变化,已知Fe2+可用K3Fe(CN)6来检验(呈蓝色).则下列说法不正确的是( )


| A、甲区呈现红色 |
| B、乙区产生Zn2+ |
| C、丙区发生的电极反应式:Cu-2e-=Cu2+ |
| D、丁区呈现蓝色 |
吸热反应一定是( )
| A、释放能量 |
| B、反应物总能量等于生成物总能量 |
| C、反应物总能量高于生成物总能量 |
| D、贮存能量 |
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.下列有关该电池设计的说法不正确的是( )
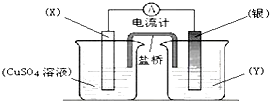

| A、电极X的材料是Cu |
| B、银电极为正极 |
| C、盐桥里Cl-移向电源的负极 |
| D、外电路中每通过0.2mol电子,银电极的质量理论上增加10.8g |
在100mL混合液中,硝酸和硫酸的物质的量浓度分别为1mol/L和4mol/L,向该混合液中加入32.5g锌,微热充分反应后,收集到标准状况下的气体为( )
| A、2.24 L |
| B、7.84 L |
| C、10.08 L |
| D、11.2 L |