题目内容
(1)向FeCl3溶液中投入适量的Zn粉,会有 放出(填化学式).
(2)室温下,向氨水中滴加盐酸,当溶液呈中性时,C(NH4+) C(Cl- )(填<或>或=)
(3)盐的水解反应为吸热反应,升高温度水解程度 (填增大或减小或等于)
(4)写出Na2CO3溶液中的电荷守恒式 .
(2)室温下,向氨水中滴加盐酸,当溶液呈中性时,C(NH4+)
(3)盐的水解反应为吸热反应,升高温度水解程度
(4)写出Na2CO3溶液中的电荷守恒式
考点:盐类水解的应用
专题:盐类的水解专题
分析:(1)FeCl3溶液水解显酸性;
(2)要使混合溶液呈中性,c(H+)=c(OH-),根据电荷守恒来判断C(NH4+)和C(Cl- )的浓度关系;
(3)盐的水解反应为吸热反应,升高温度,水解被促进;
(4)找出Na2CO3溶液中的所有的阴离子和阳离子,根据阳离子所带正电荷的浓度等于阴离子所带负电荷的浓度来列式.
(2)要使混合溶液呈中性,c(H+)=c(OH-),根据电荷守恒来判断C(NH4+)和C(Cl- )的浓度关系;
(3)盐的水解反应为吸热反应,升高温度,水解被促进;
(4)找出Na2CO3溶液中的所有的阴离子和阳离子,根据阳离子所带正电荷的浓度等于阴离子所带负电荷的浓度来列式.
解答:
解:(1)FeCl3溶液水解显酸性,故放入锌粉,会后氢气放出,故答案为:H2;
(2)混合溶液呈中性,c(H+)=c(OH-),根据电荷守恒知,此时溶液中c(NH4+)=c(Cl-),故答案为:=;
(3)盐的水解反应为吸热反应,升高温度,水解被促进,故水解程度增大,故答案为:增大;
(4)Na2CO3溶液中含Na+、H+、CO32-、OH-、HCO3-,根据阳离子所带正电荷的浓度等于阴离子所带负电荷的浓度来列式可得:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-);故答案为:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-).
(2)混合溶液呈中性,c(H+)=c(OH-),根据电荷守恒知,此时溶液中c(NH4+)=c(Cl-),故答案为:=;
(3)盐的水解反应为吸热反应,升高温度,水解被促进,故水解程度增大,故答案为:增大;
(4)Na2CO3溶液中含Na+、H+、CO32-、OH-、HCO3-,根据阳离子所带正电荷的浓度等于阴离子所带负电荷的浓度来列式可得:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-);故答案为:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-).
点评:本题考查了盐类水解的有关应用,应注意盐类溶液中的三个守恒的列式方法,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
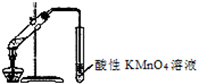 下列实验操作或实验方案设计正确的有.( )
下列实验操作或实验方案设计正确的有.( )①利用盐析分离提纯蛋白质.
②用酸性KMnO4溶液除去乙烷中的乙烯气体杂质.
③只用水鉴别乙醇、甲苯、硝基苯.
④用如图装置检验溴乙烷与NaOH醇溶液共热发生消去反应.
⑤用盐酸洗涤盛放苯酚后的试管.
⑥检验溴乙烷中的溴元素:向NaOH溶液中先加几滴溴乙烷,加热,充分反应后,冷却,再加入AgNO3溶液,观察现象.
| A、②④⑤ | B、①③⑥ |
| C、①③ | D、②④⑥ |
单糖是( )
| A、具有甜味的物质 |
| B、具有一个分子比较简单的糖 |
| C、不能在水解成更简单的糖 |
| D、最简式为的Cn(H2O)m有机物 |
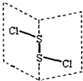 二氯化硫(S2Cl2)广泛用于橡胶工业,分子结构如图.常温下,S2Cl2是一种橙黄色液体,与水迅速反应,并生成能使品红褪色的气体.下列说法正确的是( )
二氯化硫(S2Cl2)广泛用于橡胶工业,分子结构如图.常温下,S2Cl2是一种橙黄色液体,与水迅速反应,并生成能使品红褪色的气体.下列说法正确的是( )A、S2Cl2的电子式: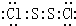 |
| B、S2Cl2为含有极性键和非极性键的非极性分子 |
| C、S2Br2与S2Cl2结构相似,熔沸点:S2Br2<S2Cl2 |
| D、S2Cl2与H2O反应化学方程式可能为:2 S2Cl2+2H2O=SO2↑+3S↓+4HCl |
下列离子中,核外有10个电子的是( )
| A、Mg2+ |
| B、S2- |
| C、K+ |
| D、Cl- |
下列离子既能电离又能水解,且能与强碱溶液反应的是( )
| A、CH3COO- |
| B、HSO4- |
| C、HSO3- |
| D、CO32- |
节能减排对发展经济、保护环境具有重要意义.下列措施不能减少二氧化碳排放的是( )
| A、利用太阳能制氢 |
| B、关停小火电企业 |
| C、举行“地球一小时”熄灯活动 |
| D、推广使用煤液化技术 |
吸热反应一定是( )
| A、释放能量 |
| B、反应物总能量等于生成物总能量 |
| C、反应物总能量高于生成物总能量 |
| D、贮存能量 |
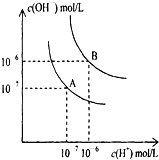 水的电离平衡曲线如图所示.
水的电离平衡曲线如图所示.