题目内容
 由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀,若用如图所示实验装置可制得纯净的Fe(OH)2沉淀.两极材料分别为石墨和铁.
由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀,若用如图所示实验装置可制得纯净的Fe(OH)2沉淀.两极材料分别为石墨和铁.(1)a电极材料为
(2)电解液d可以是
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(3)液体c为苯,其作用是
(4)为了在短时间内看到白色沉淀,可采取的措施是
A.改用稀硫酸做电解液 B.适当增大电源电压 C.适当缩小两极间距离 D.适当降低电解液温度
(5)若d改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接电源,继续电解,除了电极上看到气泡外,另一明显现象为
考点:电解原理
专题:
分析:(1)制纯净的Fe(OH)2沉淀,则Fe为阳极,失去电子,a与电源正极相连,则a为阳极;
(2)纯水导电性太差,影响物质的制备,而NaCl、NaOH溶液中氢离子放电,可生成Fe(OH)2沉淀,电解液为CuCl2溶液,发生Fe+CuCl2=Cu+FeCl2;
(3)苯的密度水的小,不溶于水,可隔绝空气,防止氢氧化亚铁被氧化;加热溶液可以排除溶液中溶解的氧气;
(4)短时间内看到白色沉淀,增大反应的速率即可;
(5)反接电源时,电解的是H2O,生成的O2会将Fe(OH)2氧化.
(2)纯水导电性太差,影响物质的制备,而NaCl、NaOH溶液中氢离子放电,可生成Fe(OH)2沉淀,电解液为CuCl2溶液,发生Fe+CuCl2=Cu+FeCl2;
(3)苯的密度水的小,不溶于水,可隔绝空气,防止氢氧化亚铁被氧化;加热溶液可以排除溶液中溶解的氧气;
(4)短时间内看到白色沉淀,增大反应的速率即可;
(5)反接电源时,电解的是H2O,生成的O2会将Fe(OH)2氧化.
解答:
解:(1)制纯净的Fe(OH)2沉淀,则Fe为阳极,失去电子,a与电源正极相连,则a为阳极,发生的电极反应为Fe-2e-=Fe2+,
故答案为:Fe;Fe-2e-=Fe2+;
(2)纯水导电性太差,影响物质的制备,而NaCl、NaOH溶液中氢离子放电,可生成Fe(OH)2沉淀,若白色沉淀在电极上生成,则电解液d是氢氧化钠,若白色沉淀在两极之间的溶液中生成,则电解液d是氯化钠溶液,但是若电解液为CuCl2溶液,发生Fe+CuCl2=Cu+FeCl2,则不会出现白色沉淀,故答案为:C;B;
(3)苯的密度水的小,不溶于水,可隔绝空气,防止氢氧化亚铁被氧化;加热溶液可以排除溶液中溶解的氧气;
故答案为:隔绝空气,防止产物被氧化;赶尽溶液中的氧气;
(4)短时间内看到白色沉淀,适当增大电源电压、适当缩小两电极间距离可增大反应的速率,而改用稀硫酸不能生成沉淀,降低温度反应速率减慢,故答案为:BC;
(5)反接电源时,电解方程式是2H2O
2H2↑+O2↑,生成的O2会将Fe(OH)2氧化,其现象是白色沉淀迅速变为灰绿色,最终变为红褐色,故答案为:白色沉淀迅速变为灰绿色,最后变为红褐色.
故答案为:Fe;Fe-2e-=Fe2+;
(2)纯水导电性太差,影响物质的制备,而NaCl、NaOH溶液中氢离子放电,可生成Fe(OH)2沉淀,若白色沉淀在电极上生成,则电解液d是氢氧化钠,若白色沉淀在两极之间的溶液中生成,则电解液d是氯化钠溶液,但是若电解液为CuCl2溶液,发生Fe+CuCl2=Cu+FeCl2,则不会出现白色沉淀,故答案为:C;B;
(3)苯的密度水的小,不溶于水,可隔绝空气,防止氢氧化亚铁被氧化;加热溶液可以排除溶液中溶解的氧气;
故答案为:隔绝空气,防止产物被氧化;赶尽溶液中的氧气;
(4)短时间内看到白色沉淀,适当增大电源电压、适当缩小两电极间距离可增大反应的速率,而改用稀硫酸不能生成沉淀,降低温度反应速率减慢,故答案为:BC;
(5)反接电源时,电解方程式是2H2O
| ||
点评:本题考查氢氧化亚铁的制备和电解原理,明确电解原理及Fe为阳极是解答本题的关键,注意实验中防止氢氧化亚铁被氧化,题目难度不大.

练习册系列答案
 学习实践园地系列答案
学习实践园地系列答案
相关题目
有关离子浓度大小比较的判断正确的是( )
| A、常温下NaB溶液的pH=8,c(Na+)-c(B-)=1×10-2 mol/L |
| B、Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| C、KHSO3溶液呈酸性,c(K+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-) |
| D、0.1mol?L-1 NH4Cl和0.1mol?L-1 NH3?H2O等体积混合后溶液呈碱性:c(NH3?H2O)>c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
已知分子式为C10H14的分子,不能使溴水褪色,但可使酸化的高锰酸钾溶液褪色.它的分子结构中含有一个烷基,它与液溴在还原铁粉存在下,反应生成物结构有3种,则此烷基的结构有( )
| A、2种 | B、3种 | C、4种 | D、5种 |
下列说法正确的是( )
| A、2-二甲基-2-溴丁烷发生消去反应后的生成物不存在同分异构体 |
| B、在CH3-CH=CH-C≡C-CF3分子中,6个碳原子一定不在同一平面上 |
| C、由2-氯丙烷制取1,2-丙二醇时,需要经过取代→消去→加成三步反应完成 |
| D、将铜丝在酒精灯火焰上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 |
下列离子中,核外有10个电子的是( )
| A、Mg2+ |
| B、S2- |
| C、K+ |
| D、Cl- |
常温下,下列溶液中酸性最弱的是( )
| A、pH=4 |
| B、[H+]=1×10-3 mol?L-1 |
| C、[OH-]=1×10-11 mol?L-1 |
| D、[H+]?[OH-]=1×10-14 |
某校活动小组为探究金属腐蚀的相关原理,设计了如图a所示装置,图a的铁棒末段分别连上一块Zn片和Cu片,并静置于含有K3Fe(CN)6及酚酞的混合凝胶上.一段时间后发现凝胶的某些区域(如图b示)发生了变化,已知Fe2+可用K3Fe(CN)6来检验(呈蓝色).则下列说法不正确的是( )


| A、甲区呈现红色 |
| B、乙区产生Zn2+ |
| C、丙区发生的电极反应式:Cu-2e-=Cu2+ |
| D、丁区呈现蓝色 |
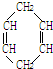 可简写为
可简写为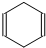 .现有某化合物W的分子结构可表示为
.现有某化合物W的分子结构可表示为 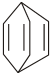 .
.