题目内容
下列有关仪器的使用,能实现的是 ( )
| A、用托盘天平称取11.7g食盐 |
| B、用量筒量取12.36ml盐酸 |
| C、用酸式滴定管量取21.20ml 0.10mol/L H2SO4溶液 |
| D、用200ml容量瓶配制500ml 0.1mol/L NaCl溶液 |
考点:不能加热的仪器及使用方法
专题:
分析:A.托盘天平的最小读数为0.1g;
B.量筒的最小读数为0.1mL,无法量取到0.01mL盐酸;
C.硫酸为酸性溶液,滴定管能够读到0.01mL,据此进行判断;
D.容量瓶只能配置固定体积的溶液.
B.量筒的最小读数为0.1mL,无法量取到0.01mL盐酸;
C.硫酸为酸性溶液,滴定管能够读到0.01mL,据此进行判断;
D.容量瓶只能配置固定体积的溶液.
解答:
解:A.托盘天平的最小读数能读到0.1g,用托盘天平能称取11.7g食盐,故A正确;
B.量筒的最小读数为0.1mL,无法用量筒量取12.36mL的盐酸,需要使用酸式滴定管量取,故B错误;
C.滴定管能够读到0.01mL的溶液,可以用酸式滴定管量取21.20mL 0.10mol/L H2SO4溶液,故C正确;
D.配制500mL 0.1mol/L NaCl溶液应选500mL容量瓶,故D错误.
故选AC.
B.量筒的最小读数为0.1mL,无法用量筒量取12.36mL的盐酸,需要使用酸式滴定管量取,故B错误;
C.滴定管能够读到0.01mL的溶液,可以用酸式滴定管量取21.20mL 0.10mol/L H2SO4溶液,故C正确;
D.配制500mL 0.1mol/L NaCl溶液应选500mL容量瓶,故D错误.
故选AC.
点评:本题考查了计量仪器的构造及其使用方法,题目难度不大,注意掌握常见仪器的精确度.

练习册系列答案
相关题目
除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的是( )
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 淀粉(氯化钠) | 蒸馏水 | 渗析 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| D | 乙烷(乙烯) | 氢气 | 加热 |
| A、A | B、B | C、C | D、D |
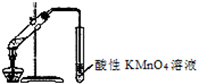 下列实验操作或实验方案设计正确的有.( )
下列实验操作或实验方案设计正确的有.( )①利用盐析分离提纯蛋白质.
②用酸性KMnO4溶液除去乙烷中的乙烯气体杂质.
③只用水鉴别乙醇、甲苯、硝基苯.
④用如图装置检验溴乙烷与NaOH醇溶液共热发生消去反应.
⑤用盐酸洗涤盛放苯酚后的试管.
⑥检验溴乙烷中的溴元素:向NaOH溶液中先加几滴溴乙烷,加热,充分反应后,冷却,再加入AgNO3溶液,观察现象.
| A、②④⑤ | B、①③⑥ |
| C、①③ | D、②④⑥ |
对于某合成材料(如塑料制品)废弃物的处理方法中正确的是( )
| A、将废弃物混在垃圾中填埋在土壤中 |
| B、将废弃物焚烧 |
| C、将废弃物用化学方法加工成涂料或汽油 |
| D、将废弃物倾倒在海洋中 |
下列离子中,核外有10个电子的是( )
| A、Mg2+ |
| B、S2- |
| C、K+ |
| D、Cl- |

 的所有原子
的所有原子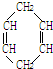 可简写为
可简写为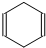 .现有某化合物W的分子结构可表示为
.现有某化合物W的分子结构可表示为 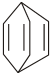 .
. 氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用.