题目内容
17.下列属于氧化还原反应的是( )| A. | 2KBr+Cl2=2KCl+Br2 | B. | CaCO3=CaO+CO2↑ | ||
| C. | SO3+H2O=H2SO4 | D. | MgCl2+2NaOH=Mg(OH)2↓+NaCl |
分析 氧化还原反应的特征是元素化合价的升降,可根据元素化合价的变化解答该题.
解答 解:A.Br、Cl元素化合价发生变化,属于氧化还原反应,故A正确;
B.分解反应,元素化合价没有发生变化,不属于氧化还原反应,故B错误;
C.为化合反应,元素化合价没有发生变化,不属于氧化还原反应,故C错误;
D.为复分解反应,元素化合价没有发生变化,不属于氧化还原反应,故D错误.
故选A.
点评 本题考查氧化还原反应,侧重于学生的分析能力的考查,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,难度不大.

练习册系列答案
相关题目
11.下列各组中的四种物质,只用一种试剂即可鉴别的是( )
| A. | 淀粉溶液、乙醇、苯、四氯化碳 | B. | 乙烯、乙烷、乙炔、丙烯 | ||
| C. | 甲酸、乙醛、乙醇、乙酸 | D. | 苯酚、溴苯、苯、甲苯 |
8.关于下列有机物的说法正确的是( )
| A. | 苯与溴能发生取代反应,因此不能用苯萃取溴水中的溴 | |
| B. | 相同质量的苯和立方烷(C${\;}_{{8}_{\;}}$H8)完全燃烧,耗氧量一样多 | |
| C. | 乙烯和聚乙烯都能发生加成反应 | |
| D. | 为了防止蛋白质盐析,疫苗等生物制剂应冷冻储存 |
5.碳酸锂(相对分子质量74)广泛应用于化工、冶金、陶瓷、医药、制冷、焊接、锂合金等行业.制备流程如图:
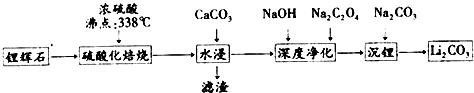
已知:碳酸锂的溶解度为(g/L)
(1)锂辉石(Li2Al2Si4Ox)可以用氧化物的形式表示其组成,形式为Li2O•Al2O3•4SiO2
(2)硫酸化焙烧工业反应温度控制在250-300℃,主要原因是温度低于250℃,反应速率较慢,温度高于300℃,硫酸挥发较多;同时,硫 酸用量为理论耗酸量的115%左右,硫酸如果加入过多则ABC(填入选项代号).
A.增加酸耗量 B.增加后续杂质的处理量 C.增加后续中和酸的负担
(3)水浸时,需要在搅拌下加入石灰石粉末的主要作用是除去多余的硫酸,同时调整pH,除去大部分杂质.
(4)“沉锂”的化学反应方程式为Na2CO3+Li2SO4=Li2CO3↓+Na2SO4
(5)“沉锂”需要在95℃以上进行,主要原因是温度越高,碳酸锂溶解度降低,可以增加产率.过滤碳酸锂所得母液 中主要含有硫酸钠,还可能含有碳酸钠和碳酸锂.

已知:碳酸锂的溶解度为(g/L)
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| Li2CO3 | 1.54 | 1.43 | 1.33 | 1.25 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
(2)硫酸化焙烧工业反应温度控制在250-300℃,主要原因是温度低于250℃,反应速率较慢,温度高于300℃,硫酸挥发较多;同时,硫 酸用量为理论耗酸量的115%左右,硫酸如果加入过多则ABC(填入选项代号).
A.增加酸耗量 B.增加后续杂质的处理量 C.增加后续中和酸的负担
(3)水浸时,需要在搅拌下加入石灰石粉末的主要作用是除去多余的硫酸,同时调整pH,除去大部分杂质.
(4)“沉锂”的化学反应方程式为Na2CO3+Li2SO4=Li2CO3↓+Na2SO4
(5)“沉锂”需要在95℃以上进行,主要原因是温度越高,碳酸锂溶解度降低,可以增加产率.过滤碳酸锂所得母液 中主要含有硫酸钠,还可能含有碳酸钠和碳酸锂.
12.常温下,甲、乙、丙三位同学用实验确定某酸HA是弱电解质的方案分别是:
甲:用pH试纸测定0.1moI/L HA溶液的pH,即可证明HA是弱电解质;
乙:①分别取pH=l的HA溶液和稀盐酸各10.00mL,再加水稀释为100mL;
②各取相同体积的两种稀释液(适量),同时分别加入纯度和形状大小均相同的锌粒(足量),观察现象,即可证明HA是弱电解质;
丙:将适量的HA溶液和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表,分析表中数据可以说明HA是弱电解质;
(1)甲的方案中,说明HA是弱电解质的理由是测得溶液的pH>1(填“>”、“<”或“=”).甲进行实验时的具体操作方法是先把一小块pH试纸放在表面皿或玻璃片上,再用玻璃棒蘸驭溶液点在试纸的中部,待变色后,与标准比色卡对比确定溶液的pH.
(2)在乙的方案的第①步中,需要用到的定量仪器是酸式滴定管.pH均为1的HA溶液和稀盐酸中,水的电离程度的大小关系是c(填字母).
a.HA溶液中水的电离程度大 b.稀盐酸中水的电离程度大 c.两种溶液中水的电离程度相同
(3)乙的方案中,说明HA是弱电解质的主要现象是B(填字母).
A.装稀盐酸的试管中放出H2的速率快
B.装HA溶液的试管中放出H2的速率快
C.两个试管中产生气体的速率一样快
(4)丙的方案中,编号②中的c>(填“>”、“<”或“=”)0.l,该混合液中的离子浓度:c(Na+)=(填“>”、“<”或“=”)c(A-).
(5)丙的方案中,编号③的数据表明,混合溶液中HA的电离程度比NaA的水解程度:强(填“强”、“弱”或“无法确定”).
甲:用pH试纸测定0.1moI/L HA溶液的pH,即可证明HA是弱电解质;
乙:①分别取pH=l的HA溶液和稀盐酸各10.00mL,再加水稀释为100mL;
②各取相同体积的两种稀释液(适量),同时分别加入纯度和形状大小均相同的锌粒(足量),观察现象,即可证明HA是弱电解质;
丙:将适量的HA溶液和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表,分析表中数据可以说明HA是弱电解质;
| 编号 | NaOH/mol•L-1 | HA/mol•L-1 | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.1 | 0.2 | pH<7 |
(2)在乙的方案的第①步中,需要用到的定量仪器是酸式滴定管.pH均为1的HA溶液和稀盐酸中,水的电离程度的大小关系是c(填字母).
a.HA溶液中水的电离程度大 b.稀盐酸中水的电离程度大 c.两种溶液中水的电离程度相同
(3)乙的方案中,说明HA是弱电解质的主要现象是B(填字母).
A.装稀盐酸的试管中放出H2的速率快
B.装HA溶液的试管中放出H2的速率快
C.两个试管中产生气体的速率一样快
(4)丙的方案中,编号②中的c>(填“>”、“<”或“=”)0.l,该混合液中的离子浓度:c(Na+)=(填“>”、“<”或“=”)c(A-).
(5)丙的方案中,编号③的数据表明,混合溶液中HA的电离程度比NaA的水解程度:强(填“强”、“弱”或“无法确定”).
2.下列说法正确的是( )
| A. | 某试样焰色反应呈黄色,则试样中含有K+ | |
| B. | 广泛pH试纸测得某碱性溶液的pH为12.5 | |
| C. | 容量瓶不能用作溶解物质的容器 | |
| D. | 粗盐的提纯试验中,滤液在坩埚中加热蒸发结晶 |
9.下列说法不正确的是( )
| A. | 硬脂酸甘油酯属于高级脂肪酸甘油酯,是高分子化合物 | |
| B. | 含淀粉或纤维素的物质可以制造酒精 | |
| C. | 鸡蛋清的溶液中加入硫酸铜溶液,鸡蛋清凝聚,蛋白质变性 | |
| D. | 不同种类的氨基酸能以不同的数目和顺序彼此结合,形成更复杂的多肽化合物 |
6.下列说法正确的是( )
| A. | 烷烃C5H12的同分异构体中,主链最短的一种系统命名为2,2-甲基丙烷 | |
| B. | 石油分馏和裂化的目的都是为了将长链烃转化为短链烃 | |
| C. | 蛋白质溶液中加入硫酸铜溶液,导致蛋白质变性,失去生理活性 | |
| D. | 高分子化合物(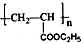 )的单体是CH2=CH2和C2H5COOH )的单体是CH2=CH2和C2H5COOH |
7.下列实验方案能达到实验目的是( )
| 选项 | 实验方案 | 实验目的或结论 |
| A | 取一个小木条,放入饱和硅酸钠溶液中,充分吸湿、浸透,取出稍沥干后,置于酒精灯外焰处,木条未燃烧 | 证明硅酸钠可作木材防火剂 |
| B | 向取好未知浓度氢氧化钠溶液的锥形瓶中加入2mL酚酞,然后进行正确滴定,最后一滴盐酸滴入,溶液由红色变为无色且半分钟不恢复 | 准确判断已知浓度的盐酸滴定未知浓度的氢氧化钠溶液的滴定的终点 |
| C | 向装有石灰石的简易启普发生器中加入浓醋酸,将产生的气体先通入饱和碳酸氢钠溶液,再通入苯酚钠溶液中,苯酚钠溶液产生浑浊 | 酸性:醋酸>碳酸>苯酚 |
| D | 向盛有苯酚的浓溶液的试管里逐滴加入稀溴水,边滴边振荡 | 苯酚的定性检验 |
| A. | A | B. | B | C. | C | D. | D |