题目内容
2.己知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(NH4+)>c(OH-)>c(Cl-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白:
(1)若溶液中只有一种溶质,则该溶质是NH4Cl.
(2)若四种离子的关系符合③,则溶质为NH4C1和NH3•H2O;若四种离子的关系符合④,则溶质为NH4Cl和HCl.
(3)将pH相同的NH4Cl溶液稀释相同的倍数,下面图象正确的是(填图象序号)B.

分析 (1)任何水溶液中都有OH-、H+,若溶质只有一种则为NH4Cl;
(2)由③中离子的关系可知溶液显碱性,且c(NH4+)>c(Cl-),则溶液为氯化铵和氨水的混合溶液;由④中的离子关系可知溶液显酸性,且c(Cl-)>c(H+)>c(NH4+),则溶液为盐酸与氯化铵的混合溶液;
(3)pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,盐酸为强电解质,则pH变化程度大,而稀释时促进氯化铵中铵根离子水解,则pH变化小.
解答 解:(1)因任何水溶液中都有OH-、H+,若溶质只有一种则为NH4Cl,故答案为:NH4Cl;
(2)③中离子的关系可知溶液显碱性,且c(NH4+)>c(Cl-),则溶液为氯化铵和氨水的混合溶液,其溶质为NH4C1 和 NH3•H2O;
④中的离子关系可知溶液显酸性,且c(Cl-)>c(H+)>c(NH4+),则溶液为盐酸与氯化铵的混合溶液,其溶质为HCl、NH4Cl,
故答案为:NH4C1 和 NH3•H2O;NH4Cl和HCl;
(3)pH相同的NH4Cl溶液和HCl溶液稀释时氢离子的浓度都变小,则pH都变大,但盐酸为强电解质,则pH变化程度大,而氯化铵水解显酸性,稀释促进水解,氢离子浓度减小的倍数小于盐酸中氢离子浓度的变化,则pH变化小,只有B符合题意,
故答案为:B.
点评 本题考查离子浓度大小的比较,题目较难,考查学生利用离子的关系来分析溶液中的溶质,明确溶液中的电离和水解是解答本题的关键,并注意(3)是学生解答的难点,与强酸、弱酸的稀释相似.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.恒温恒容,可逆反应:2NO2?2NO+O2达到平衡状态的标志是( )
①单位时间内生成n molO2的同时生成2n molNO2
②2v(NO2、正)=v(O2、逆)
③用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态.
①单位时间内生成n molO2的同时生成2n molNO2
②2v(NO2、正)=v(O2、逆)
③用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态.
| A. | ①④⑥ | B. | ②③⑤ | C. | ①③④ | D. | ①②③④⑤⑥ |
10.糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质.以下叙述正确的是( )
| A. | 植物油存放过久,会有一种难闻的“哈喇”味,但不影响食用 | |
| B. | 葡萄糖能发生水解反应 | |
| C. | 淀粉和纤维素水解的最终产物是葡萄糖 | |
| D. | 氨基酸分子中含有氨基和羧基,因此具有两性,但蛋白质没有两性 |
14. 甲乙丙丁戊是中学常见的无机物,他们的转化关系如图所示(某些条件和部分产物已略去).下列说法错误的是( )
甲乙丙丁戊是中学常见的无机物,他们的转化关系如图所示(某些条件和部分产物已略去).下列说法错误的是( )
 甲乙丙丁戊是中学常见的无机物,他们的转化关系如图所示(某些条件和部分产物已略去).下列说法错误的是( )
甲乙丙丁戊是中学常见的无机物,他们的转化关系如图所示(某些条件和部分产物已略去).下列说法错误的是( )| A. | 若戊为一种强碱且焰色反应为黄色,则上述反应可能都属于氧化还原反应 | |
| B. | 常温下,若丙为无色气体,戊为红棕色气体,则甲、乙一定是铜和稀硝酸 | |
| C. | 若甲为硫磺燃烧产物,丁为水,则戊可用于干燥甲 | |
| D. | 若甲为浓盐酸,乙为MnO2,则戊可能使品红褪色 |
1. 2013年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.
2013年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.
(1)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径.目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H>0.
①写出该反应的平衡常数表达式K=$\frac{[CH{\;}_{3}OCH{\;}_{3}]•[H{\;}_{2}O]{\;}^{3}}{[CO{\;}_{2}]{\;}^{2}•[H{\;}_{2}]{\;}^{6}}$.
②判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是BD.
A.容器中密度不变
B.单位时间内消耗2molCO2,同时消耗1mol二甲醚
C.v(CO2):v(H2)=1:3
D.容器内压强保持不变
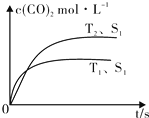
(2)汽车尾气净化的主要原理为:2NO(g)+2CO (g) $\stackrel{催化剂}{?}$2CO2 (g)+N2 (g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示.据此判断:
①该反应的△H<0(选填“>”、“<”).
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2,在图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线.
(3)已知:CO(g)+2H2(g)?CH3OH(g)△H=-a kJ•mol-1.
①经测定不同温度下该反应的平衡常数如下:
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO)=0.4mol•L-1、c(H2)=0.4mol•L-1、c(CH3OH)=0.8mol•L-1,则此时v正<v逆(填“>”、“<”或“=”).
②某温度下,在体积固定的2L的密闭容器中将1mol CO和2mol H2混合,测得不同时刻的反应前后压强关系如下:
则前15分钟,用氢气表示的平均化学反应速率为0.02mol•(L•min)-1,达到平衡时CO的转化率为45%.
 2013年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.
2013年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.(1)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径.目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H>0.
①写出该反应的平衡常数表达式K=$\frac{[CH{\;}_{3}OCH{\;}_{3}]•[H{\;}_{2}O]{\;}^{3}}{[CO{\;}_{2}]{\;}^{2}•[H{\;}_{2}]{\;}^{6}}$.
②判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是BD.
A.容器中密度不变
B.单位时间内消耗2molCO2,同时消耗1mol二甲醚
C.v(CO2):v(H2)=1:3
D.容器内压强保持不变
(2)汽车尾气净化的主要原理为:2NO(g)+2CO (g) $\stackrel{催化剂}{?}$2CO2 (g)+N2 (g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示.据此判断:
①该反应的△H<0(选填“>”、“<”).
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2,在图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线.
(3)已知:CO(g)+2H2(g)?CH3OH(g)△H=-a kJ•mol-1.
①经测定不同温度下该反应的平衡常数如下:
| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,在体积固定的2L的密闭容器中将1mol CO和2mol H2混合,测得不同时刻的反应前后压强关系如下:
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
 麻黄素中含氧官能团的名称是羟基,属于醇类(填“醇”或“酚”).
麻黄素中含氧官能团的名称是羟基,属于醇类(填“醇”或“酚”).