题目内容
1.W、X、Y、Z四种短周期主族元素在周期表中的相对位置如图所示,由此可知( )| X | Y | ||
| W | Z |
| A. | Z元素氢化物的水溶液一定是强酸 | |
| B. | 四种元素原子形成的简单离子,半径最小的一定是Y | |
| C. | 四种元素最高价氧化物对应的水化物酸性最强的一定是Y | |
| D. | 四种元素对应的简单氢化物稳定性最强的一定是Y |
分析 W、X、Y、Z是四种短周期主族元素,根据周期表结构知,X和Y位于第二周期而W和Z位于第三周期;
W可能是第IA族到第IVA族元素,
A.Z元素的氢化物可能是SiH4、PH3、H2S或HCl;
B.电子层数越多离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外;
D.元素的非金属性越强,其简单氢化物的稳定性越强.
解答 解:W、X、Y、Z是四种短周期主族元素,根据周期表结构知,X和Y位于第二周期而W和Z位于第三周期;
W可能是第IA族到第IVA族元素,
A.Z元素的氢化物可能是SiH4、PH3、H2S或HCl,硫化氢水溶液是弱酸,所以Z元素的氢化物水溶液不一定是强酸,故A错误;
B.电子层数越多离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小,这几种元素形成的简单离子,如果W是第IA族元素,则离子半径最小的是W离子;如果W是第IVA族元素,则离子半径最小的是Y离子,故B错误;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外,这几种元素非金属性最强的是Y元素,则但如果Y是O、F元素,其没有最高价氧化物的水化物,故C错误;
D.元素的非金属性越强,其简单氢化物的稳定性越强,这几种元素非金属性最强的是Y元素,所以Y元素的氢化物稳定性最强,故D正确;
故选D.
点评 本题考查原子结构和元素性质,为高频考点,侧重考查学生分析判断及发散思维能力,注意规律中的异常现象,易错选项是C.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.取一定质量的均匀固体混合物Cu、Cu2O和CuO,将其分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少3.20g,另一份加入1000mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体2.24L,则所用硝酸的物质的量浓度为( )
| A. | 0.8mol/L | B. | 1.6mol/L | C. | 0.9mol/L | D. | 1.8mol/L |
6.铁在高温下与水蒸气反应的固体产物是( )
| A. | FeO | B. | Fe2O3 | C. | Fe3O4 | D. | Fe(OH)2 |
12.乙酸橙花酯是一种食用香料,其结构简式如图,关于该有机物的叙述中不正确的是( )
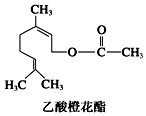

| A. | 分子式为C12H20O2 | |
| B. | 1 mol该有机物水解时只能消耗1 mol NaOH | |
| C. | 1mol该有机物可消耗3molH2 | |
| D. | 不能发生银镜反应 |
8.设NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 常温常压下,16g甲烷所含原子数为4NA | |
| B. | 标准状况下,2.24LCH4和NH3混合气气体中含有的电子数目为NA | |
| C. | 标准状况下,11.2L的HCl溶于1.0L的水中,所得溶液中HCl的浓度为0.5mol/L | |
| D. | 常温下,5.6克铁与足量的盐酸反应,失去的电子数为0.2mol |
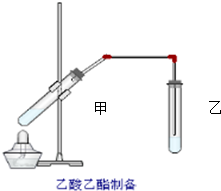 如图在试管甲中先加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2克无水乙酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5ml 饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小火加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.试回答:
如图在试管甲中先加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2克无水乙酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5ml 饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小火加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.试回答:

