题目内容
17.取一定质量的均匀固体混合物Cu、Cu2O和CuO,将其分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少3.20g,另一份加入1000mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体2.24L,则所用硝酸的物质的量浓度为( )| A. | 0.8mol/L | B. | 1.6mol/L | C. | 0.9mol/L | D. | 1.8mol/L |
分析 取一定质量的均匀固体混合物Cu、Cu2O和CuO,将其分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少3.20g,减少的即为混合物中的O原子的质量,据此求出n(O),根据在混合物中氧元素的价态为-2价,可知混合物中铜元素的价态之和;然后根据和硝酸反应后生成NO0.1mol,可知混合物共失去0.3mol电子,并生成Cu(NO3)2,从而求出混合物反应后的价态,即可求出做酸的硝酸的物质的量,从而求出硝酸的总物质的量和物质的量浓度.
解答 解:取一定质量的均匀固体混合物Cu、Cu2O和CuO,将其分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少3.20g,减少的即为混合物中的O原子的质量,即n(O)=$\frac{3.2g}{16g/mol}$=0.2mol,而由于在混合物中氧元素的价态为-2价,可知混合物中铜元素所带正电荷为0.4mol.
而混合物和硝酸反应后生成NO体积为2.24L即0.1mol,可知混合物共失去0.3mol电子,并生成Cu(NO3)2,即所得Cu(NO3)2中铜元素所带正电荷的物质的量之和为0.7mol,故做酸的硝酸的物质的量为0.7mol,而由于硝酸在反应时的作用有两个:做酸和做氧化剂,故可知,硝酸的总物质的量为0.7mol+0.1mol=0.8mol.
而硝酸的体积为1L,故硝酸的物质的量浓度为c=$\frac{0.8mol}{1L}$=0.8mol/L,
故选A.
点评 本题考查混合物的计算、守恒计算等,难度中等,清楚反应过程是解题的关键,简化计算过程,注意体会.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
8.下列反应属于一定是放热反应的是( )
| A. | 电解质电离 | B. | Na2CO3水解 | C. | 物质溶解 | D. | 强酸与强碱反应 |
5.Se、Br两种元素的部分信息如如图所示,下列说法正确的是( )
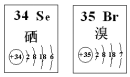

| A. | 原子半径:Br>Se | B. | 还原性:Se2-<Br- | ||
| C. | 在Se2Br2分子中只含有极性键 | D. | SeO2 既有氧化性又有还原性 |
1.W、X、Y、Z四种短周期主族元素在周期表中的相对位置如图所示,由此可知( )
| X | Y | ||
| W | Z |
| A. | Z元素氢化物的水溶液一定是强酸 | |
| B. | 四种元素原子形成的简单离子,半径最小的一定是Y | |
| C. | 四种元素最高价氧化物对应的水化物酸性最强的一定是Y | |
| D. | 四种元素对应的简单氢化物稳定性最强的一定是Y |
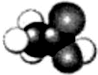 乙酸是食醋的主要成分,它的分子结构模型如图所示.
乙酸是食醋的主要成分,它的分子结构模型如图所示.