题目内容
12.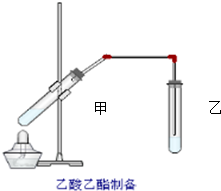 如图在试管甲中先加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2克无水乙酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5ml 饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小火加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.试回答:
如图在试管甲中先加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2克无水乙酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5ml 饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小火加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.试回答:(1)试管乙中观察到的现象是液体分层,产生气泡
(2)液体混合加热时液体容积不能超过其容积的$\frac{1}{3}$,本实验反应开始时用小火加热的原因是加快反应速率,同时又防止了反应物未来得及反应而挥发损失;(已知乙酸乙酯的沸点为77℃;乙醇的沸点为78.5℃;乙酸的沸点为117.9℃)
(3)试管甲中加入浓硫酸的目的是催化剂、吸水剂
(4)该实验中长导管的作用是导气、冷凝,其不宜伸入试管乙的溶液中,原因是防止加热不充分而倒吸
(5)试管乙中饱和Na2CO3的作用是除去乙酸乙酯中的乙醇和乙酸,降低乙酸乙酯的溶解度,便于分层析
(6)写出试管甲中发生反应的化学方程式2CH3COONa+H2SO4+2CH3CH2OH$→_{△}^{浓硫酸}$2CH3COOC2H5+2H2O+Na2SO4.
分析 (1)试管乙饱和碳酸钠溶液中,生成的乙酸乙酯在水溶液上层,试管中观察到的现象是:溶液分层,在饱和碳酸钠上层产生有特殊香味的无色液体;
(2)依据实验基本操作分析,液体混合加热时液体容积不能超过其容积的三分之一,开始时用小火加热的原因是加快反应速率,避免反应物的挥发;
(3)浓硫酸的作用是利用酸性和醋酸钠制乙酸,浓硫酸做酯化反应的催化剂和吸水剂;
(4)加热反应过程中乙醇、乙酸乙挥发出,长导管起到冷凝作用,不宜伸入试管乙的溶液中是防止加热不充分发生倒吸;
(5)实验室里用饱和碳酸钠溶液冷却乙酸乙酯的原因:一是利用碳酸钠溶液中的水溶解乙醇(乙醇在水里的溶解度大于乙酸乙酯),二是碳酸钠能跟乙酸反应吸收乙酸,便于闻到乙酸乙酯的香味,而乙酸乙酯难溶于饱和碳酸钠溶液,这样就可以获得较为纯净的乙酸乙酯液体;
(6)装置中发生的反应是利用醋酸钠和浓硫酸反应生成醋酸和乙醇在浓硫酸催化作用下发生酯化反应,生成乙酸乙酯和水.
解答 解:(1)试管乙饱和碳酸钠溶液中,生成的乙酸乙酯在水溶液上层,试管中观察到的现象是:液体分层,在饱和碳酸钠上层产生有特殊香味的无色液体,
故答案为:液体分层,产生气泡;
(2)液体混合加热时液体容积不能超过其容积的三分之一,开始时用小火加热的原因是加快反应速率,避免为反应的反应物的挥发;
故答案为:$\frac{1}{3}$;加快反应速率,同时又防止了反应物未来得及反应而挥发损失;
(3)用酸性和醋酸钠制乙酸,浓硫酸有吸水性,促进该反应向正反应方向移动,浓硫酸能加快反应速率,所以浓硫酸作酸、催化剂和吸水剂,
故答案为:催化剂、吸水剂;
(4)已知乙酸乙酯的沸点为77℃;乙醇的沸点为78.5℃;乙酸的沸点为117.9℃,加热反应过程中乙醇、乙酸乙挥发出,长导管起到冷凝作用,不宜伸入试管乙的溶液中是防止加热不充分发生倒吸;
故答案为:导气、冷凝;防止加热不充分而倒吸;
(5)碳酸钠溶液中的水溶解乙醇,能跟乙酸反应吸收乙酸,便于闻到乙酸乙酯的香味,降低乙酸乙酯的溶解度,使乙酸乙酯难溶于饱和碳酸钠溶液,便于分层,
故答案为:除去乙酸乙酯中的乙醇和乙酸,降低乙酸乙酯的溶解度,便于分层析;
(6)装置中发生的反应是利用醋酸钠和浓硫酸反应生成醋酸和乙醇在浓硫酸催化作用下发生酯化反应,生成乙酸乙酯和水,反应的化学方程式为2CH3COONa+H2SO4+2CH3CH2OH$→_{△}^{浓硫酸}$2CH3COOC2H5+2H2O+Na2SO4,
故答案为:2CH3COONa+H2SO4+2CH3CH2OH$→_{△}^{浓硫酸}$2CH3COOC2H5+2H2O+Na2SO4.
点评 本题考查乙酸乙酯的制备,题目难度中等,本题注意把握乙酸乙酯的制备原理和实验方法,学习中注重实验评价能力的培养.

 ABC考王全优卷系列答案
ABC考王全优卷系列答案| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式K=$\frac{c(CO)c({H}_{2}O)}{c(C{O}_{2})c({H}_{2})}$.
(2)该反应为吸热反应(填“吸热”或“放热”).
(3)830℃,在1L的固定容器的密闭容器中放入1mol CO和5mol H2O,反应达平衡后,其化学平衡常数K等于1.0(填“大于”、“小于”或“等于”)
(4)830℃,容器中的反应达到平衡.在其他条件不变的情况下,扩大容器的体积,平衡不移动.(填“向正方向”、“向逆方向”或“不”)
(5)若1200℃时,在某时刻该容器中CO2、H2、CO、H2O的浓度分别为2mol•L-1、2mol•L-1、4mol•L-1、4mol•L-1,则此时上述反应的平衡移动方向为逆反应方向(选填“正反应方向”、“逆反应方向”、“不移动”).
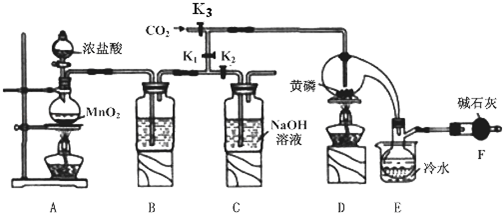
已知:
①黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;
②PCl3遇水会强烈水解生成H3PO3和HC1;
③PCl3遇O2会生成POCl3,POCl3溶于PCl3;
④PCl3、POCl3的熔沸点见表:
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
(1)A装置中制氯气的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)B中所装试剂是浓硫酸,F中碱石灰的作用有两种,分别是吸收多余的氯气、防止空气中的H2O进入烧瓶和PCl3 反应.
(3)实验时,检査装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷.通干燥CO2的作用是排尽装置中的空气,防止白磷自燃.
(4)粗产品中常含有POCl3、PCl5等,加入黄磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到较纯净的PCl3.
(5)实验结束时,可以利用C中的试剂吸收多余的氯气,C中反应的离子方程式为Cl2+2OH-=Cl-+ClO-+2H2O.
(6)通过下面方法可测定产品中PCl3的质量分数
①迅速称取1.00g产品,加水反应后配成250mL溶液;
②取以上溶液25.00mL,向其中加入10.00mL 0.1000mol/L碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol/L的Na2S2O3溶液滴定;
④重复②、③操作平均消耗Na2S2O3溶液8.40mL.
已知:H3PO3+H2O+I2═H3PO4+2HI,I2+2Na2S2O3═2NaI+Na2S4O6,假设测定过程中没有其他反应.根据上述数据,该产品中PC13的质量分数为79.75%.
| A. | 相同条件下,2 mol SO2(g)和1 mol O2(g)的键能之和大于2 mol SO3(g)的键能 | |
| B. | 如将一定量的SO2(g)和O2(g)置于某密闭容器中充分反应后放热Q kJ,则此过程中有2 mol SO2(g)被氧化 | |
| C. | 增大压强或升高温度,该平衡都向逆反应方向移动 | |
| D. | 将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后,放出热量为Q kJ |
| A. | 碳酸钙在水中的溶解度很小,其水溶液电阻率很大,所以它是弱电解质 | |
| B. | 碳酸钙在水中的溶解度很小,但溶于水的碳酸钙完全电离,所以碳酸钙是强电解质 | |
| C. | 氯气与氨气的水溶液导电性好,所以他们是强电解质 | |
| D. | 液态的二氧化硫不导电,但溶于水后溶液导电,所以二氧化硫是强电解质 |
| A. | 向氨水中滴入盐酸:OH-+H+=H2O | |
| B. | 石灰乳与Na2CO3溶液反应:Ca2++CO32-=CaCO3↓ | |
| C. | 向澄清石灰水中通入少量二氧化碳:Ca2++2OH-+CO2=CaCO3↓+H2O | |
| D. | 向沸水中逐滴滴加FeCl3饱和溶液:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3 H+ |
| X | Y | ||
| W | Z |
| A. | Z元素氢化物的水溶液一定是强酸 | |
| B. | 四种元素原子形成的简单离子,半径最小的一定是Y | |
| C. | 四种元素最高价氧化物对应的水化物酸性最强的一定是Y | |
| D. | 四种元素对应的简单氢化物稳定性最强的一定是Y |
 乙酸是食醋的主要成分,它的分子结构模型如图所示.
乙酸是食醋的主要成分,它的分子结构模型如图所示.