题目内容
某温度下,在装有催化剂的容积为2L的反应容器中,充入SO2和O2各4mol,充分反应5min后达到平衡,测得反应容器内混合气体的压强为原来的80%.回答:
(1)用O2的浓度变化来表示反应的化学反应速率;
(2)求混合气体中,SO3的物质的量分数;
(3)求SO2的转化率;
(4)求该反应的平衡常数.
(1)用O2的浓度变化来表示反应的化学反应速率;
(2)求混合气体中,SO3的物质的量分数;
(3)求SO2的转化率;
(4)求该反应的平衡常数.
考点:化学平衡的计算
专题:化学平衡专题
分析:(1)设出氧气的物质的量,然后根据差量法及压强关系列式计算出达到平衡时消耗氧气的物质的量,然后计算出用O2的浓度变化来表示反应的化学反应速率;
(2)根据(1)的计算结果计算出达到平衡时混合气体的物质的量、三氧化硫的物质的量,然后计算出三氧化硫的物质的量分数;
(3)计算出反应消耗的二氧化硫的物质的量,再根据转化率的表达式计算出二氧化硫的转化率;
(4)计算出达到平衡时各组分的浓度,然后根据平衡常数的表达式计算出该温度下该反应的平衡常数.
(2)根据(1)的计算结果计算出达到平衡时混合气体的物质的量、三氧化硫的物质的量,然后计算出三氧化硫的物质的量分数;
(3)计算出反应消耗的二氧化硫的物质的量,再根据转化率的表达式计算出二氧化硫的转化率;
(4)计算出达到平衡时各组分的浓度,然后根据平衡常数的表达式计算出该温度下该反应的平衡常数.
解答:
解:设达到平衡时消耗氧气的物质的量为x,
则:2SO2(g)+O2(g)?2SO3(g)△n
2 1 2 1
x x
达到平衡时气体的总物质的量为:4mol+4mol-x=8mol-x,
压强和物质的量成正比,则:
=80%,
解得:x=1.6mol,
(1)达到平衡时消耗氧气的物质的量为1.6mol,用O2的浓度变化来表示反应的化学反应速率为:v(O2)=
=0.16mol/(L?min),
答:用O2的浓度变化来表示反应的化学反应速率为0.16mol/(L?min);
(2)达到平衡时混合气体的物质的量为:8mol-1.6mol=6.4mol,
三氧化硫消耗的物质的量为:1.6mol×2=3.2mol,
三氧化硫的物质的量分数为:
×100%=50%,
答:混合气体中,SO3的物质的量分数为50%;
(3)二氧化硫的转化率为:
×100%=80%,
答:SO2的转化率为80%;
(4)达到平衡时,各组分的浓度为:c(SO2)=
=0.4mol/L,c(O2)=
=1.2mol/L,c(SO3)=
=1.6mol/L,
该温度下该反应的平衡常数为:K=
=
,
答:该温度下该反应的平衡常数为
.
则:2SO2(g)+O2(g)?2SO3(g)△n
2 1 2 1
x x
达到平衡时气体的总物质的量为:4mol+4mol-x=8mol-x,
压强和物质的量成正比,则:
| 8mol-x |
| 8mol |
解得:x=1.6mol,
(1)达到平衡时消耗氧气的物质的量为1.6mol,用O2的浓度变化来表示反应的化学反应速率为:v(O2)=
| ||
| 5min |
答:用O2的浓度变化来表示反应的化学反应速率为0.16mol/(L?min);
(2)达到平衡时混合气体的物质的量为:8mol-1.6mol=6.4mol,
三氧化硫消耗的物质的量为:1.6mol×2=3.2mol,
三氧化硫的物质的量分数为:
| 3.2mol |
| 6.4mol |
答:混合气体中,SO3的物质的量分数为50%;
(3)二氧化硫的转化率为:
| 3.2mol |
| 4mol |
答:SO2的转化率为80%;
(4)达到平衡时,各组分的浓度为:c(SO2)=
| 4mol-1.6mol×2 |
| 2L |
| 4mol-1.6mol |
| 2L |
| 3.2mol |
| 2L |
该温度下该反应的平衡常数为:K=
| 1.62 |
| 0.42×1.2 |
| 40 |
| 3 |
答:该温度下该反应的平衡常数为
| 40 |
| 3 |
点评:本题考查了化学反应速率、化学平衡常数、转化率等计算,题目难度中等,注意掌握化学反应速率、化学平衡常数的概念及计算方法,明确密闭容器中物质的量与压强成正比的关系.

练习册系列答案
相关题目
设NA为阿伏加德罗常数的数值,下列叙述正确的是( )
| A、2.24LCO2中含有的原子数为0.3NA |
| B、0.1L3mol?L-1的NH4NO3溶液中含有的NH4+数目为0.3NA |
| C、5.6g铁粉与硝酸反应失去的电子数一定为0.3NA |
| D、4.5gSiO2晶体中含有的硅氧键数目为0.3NA |

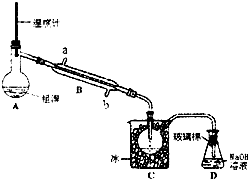 溴被称为“海洋元素“.已知Br2的沸点为590C,微溶于水,有毒性和强腐性.实验室模拟从海水中提取溴的主要步骤为:
溴被称为“海洋元素“.已知Br2的沸点为590C,微溶于水,有毒性和强腐性.实验室模拟从海水中提取溴的主要步骤为: