��Ŀ����
ͭ���仯�����������������й㷺��Ӧ�ã���ش��������⣺
��1��ijͬѧ�ú��������������ʵĹ�ҵ����ͭ��ȡ����������ͭ
�ٽ���ҵ����ͭ������ˮ�ܽ⡢���衢���˳�ȥ���������ʣ�����������Һ�к���Fe2+�IJ������� ��
������Һ�еμ�����H2O2��Һ���Լ��ȣ���Fe2+ת����ȫ��Ϊ��Fe3+ȫ��ת��ΪFe��OH��3�����������ὫCu2+ת��Ϊ����������������Cu2��OH��2CO3��ĩ�����裬�Կ�����ҺpH=3.5��������к���ˣ���ϡ�����ữ��Һ��pH=1���ٴ���Һ�з��������ͭ���壮Fe2+ת��ΪFe3+�����ӷ���ʽ�� ��
���ڲⶨ��������ͭ���壨CuSO4?xH2O��xֵ��ʵ���У�����֮�������ȴ�� ��ʵ������г����������ٽ��� �Σ�
���õõ�������ͭ����������ͭ��
��2����32.64gͭ��140mLһ��Ũ�ȵ����ᷴӦ��ͭ��ȫ�ܽ������NO��NO2��������ڱ�״���µ����Ϊ11.2L����ش𣺣�������һλС����
��NO�����Ϊ L��
�ڴ�����������ȫ���ͷź�����Һ����500mL2.2mol/L��NaOH��Һ��ǡ��ʹ��Һ�е�Cu2+ȫ��ת���ɳ�������ԭ������Һ��Ũ��Ϊ mol/L��
��1��ijͬѧ�ú��������������ʵĹ�ҵ����ͭ��ȡ����������ͭ
�ٽ���ҵ����ͭ������ˮ�ܽ⡢���衢���˳�ȥ���������ʣ�����������Һ�к���Fe2+�IJ�������
������Һ�еμ�����H2O2��Һ���Լ��ȣ���Fe2+ת����ȫ��Ϊ��Fe3+ȫ��ת��ΪFe��OH��3�����������ὫCu2+ת��Ϊ����������������Cu2��OH��2CO3��ĩ�����裬�Կ�����ҺpH=3.5��������к���ˣ���ϡ�����ữ��Һ��pH=1���ٴ���Һ�з��������ͭ���壮Fe2+ת��ΪFe3+�����ӷ���ʽ��
���ڲⶨ��������ͭ���壨CuSO4?xH2O��xֵ��ʵ���У�����֮�������ȴ��
���õõ�������ͭ����������ͭ��
��2����32.64gͭ��140mLһ��Ũ�ȵ����ᷴӦ��ͭ��ȫ�ܽ������NO��NO2��������ڱ�״���µ����Ϊ11.2L����ش𣺣�������һλС����
��NO�����Ϊ
�ڴ�����������ȫ���ͷź�����Һ����500mL2.2mol/L��NaOH��Һ��ǡ��ʹ��Һ�е�Cu2+ȫ��ת���ɳ�������ԭ������Һ��Ũ��Ϊ
���㣺���κ������ε��ת��,��ѧ����ʽ���йؼ���,����Fe���Ӻ�����Fe���ӵļ���,����ͭ�����нᾧˮ�����IJⶨ
ר�⣺
��������1�����������Ӿ��л�ԭ�ԣ��ܱ�����Ϊ���������ӣ��������������軯����ʾ��ɫ��
���������Ӿ��л�ԭ�ԣ�˫��ˮ�ܽ���������������
�۸��ݸ�������Ӧ���Լ�ʵ�����ԭ�����ش�
��2��ͭ��Ũ���ᷴӦ�õ������������淴Ӧ����Ũ�����ϡ��ͭ��ϡ���ᷴӦ�õ�NO����NO��NO2�����ʵ����ֱ�Ϊxmol��ymol�����ݶ������������ת���غ��з��̼��㣬�ٸ���V=nVm������������������������ǡ��ʹ��Һ�е�Cu2+ȫ��ת���ɳ�������ʱ��Һ������ΪNaNO3�������������غ��У�n��NaNO3��=n��NaOH������Nԭ���غ��֪��n��HNO3��=n��NaNO3��+n��NO��NO2�����ٸ������ʵ���Ũ�ȼ��㹫ʽ�����㣮
���������Ӿ��л�ԭ�ԣ�˫��ˮ�ܽ���������������
�۸��ݸ�������Ӧ���Լ�ʵ�����ԭ�����ش�
��2��ͭ��Ũ���ᷴӦ�õ������������淴Ӧ����Ũ�����ϡ��ͭ��ϡ���ᷴӦ�õ�NO����NO��NO2�����ʵ����ֱ�Ϊxmol��ymol�����ݶ������������ת���غ��з��̼��㣬�ٸ���V=nVm������������������������ǡ��ʹ��Һ�е�Cu2+ȫ��ת���ɳ�������ʱ��Һ������ΪNaNO3�������������غ��У�n��NaNO3��=n��NaOH������Nԭ���غ��֪��n��HNO3��=n��NaNO3��+n��NO��NO2�����ٸ������ʵ���Ũ�ȼ��㹫ʽ�����㣮
���
�⣺��1�����������Ӿ��л�ԭ�ԣ��ܱ���������Ϊ���������ӣ��������������軯����ʾ��ɫ��Ҫ�����������ӣ����Ը��ݵμ�����KSCN��Һ�������ټ����������Ƶ���ˮ����Һ�ʺ�ɫ���жϣ��ʴ�Ϊ��ȡ������Һ���Թ��У��μ�����KSCN��Һ�������ټ����������Ƶ���ˮ����Һ�ʺ�ɫ����֤����Һ�к���Fe2+���ӣ�
���������Ӿ��л�ԭ�ԣ�˫��ˮ�ܽ��������������������ķ�ӦΪ��2Fe2++H2O2+2H+=2Fe3++2H2O���ʴ�Ϊ��2Fe2++H2O2+2H+=2Fe3++2H2O��
���ڲⶨ��������ͭ���壨CuSO4?xH2O��xֵ��ʵ���У�����֮����ڸ���������ȴ�������������ٽ���4�Σ��ʴ�Ϊ�����ڸ���������ȴ�� 4�Σ�
��2����ͭ��Ũ���ᷴӦ�õ�����ͭ������������ˮ���淴Ӧ����Ũ�����ϡ��ͭ��ϡ���ᷴӦ��������ͭ��NO��ˮ����Ӧ����ʽΪ��Cu+4HNO3��Ũ��=Cu��NO3��2+2NO2��+2H2O��3Cu+8HNO3��ϡ��=3Cu��NO3��2+2NO��+4H2O��32.64gͭ�����ʵ���Ϊ0.51mol���ڷ�Ӧ��ʧȥ�ĵ��ӵ����ʵ���Ϊ2��0.51mol=1.02mol��11.2L�����������ʵ���Ϊ0.5mol
��NO��NO2�����ʵ����ֱ�Ϊxmol��ymol����x+y=0.5��3x+y=1.02�����x=0.26��y=0.24��
NO�����=0.26mol��22.4L/mol=5.824L��5.8L���ʴ�Ϊ��5.8��
�ڼ�����������ǡ��ʹ��Һ�е�Cu2+ȫ��ת���ɳ�������ʱ��Һ������ΪNaNO3�������������غ��У�n��NaNO3��=n��NaOH��=0.5L��2.2mol/L=1.1mol����Nԭ���غ��֪��n��HNO3��=n��NaNO3��+n��NO��NO2��=1.1mol+0.5mol=1.6mol������������ʵ���Ũ��=16mol��0.14L=11.4mol/L��
�ʴ�Ϊ��11.4��
���������Ӿ��л�ԭ�ԣ�˫��ˮ�ܽ��������������������ķ�ӦΪ��2Fe2++H2O2+2H+=2Fe3++2H2O���ʴ�Ϊ��2Fe2++H2O2+2H+=2Fe3++2H2O��
���ڲⶨ��������ͭ���壨CuSO4?xH2O��xֵ��ʵ���У�����֮����ڸ���������ȴ�������������ٽ���4�Σ��ʴ�Ϊ�����ڸ���������ȴ�� 4�Σ�
��2����ͭ��Ũ���ᷴӦ�õ�����ͭ������������ˮ���淴Ӧ����Ũ�����ϡ��ͭ��ϡ���ᷴӦ��������ͭ��NO��ˮ����Ӧ����ʽΪ��Cu+4HNO3��Ũ��=Cu��NO3��2+2NO2��+2H2O��3Cu+8HNO3��ϡ��=3Cu��NO3��2+2NO��+4H2O��32.64gͭ�����ʵ���Ϊ0.51mol���ڷ�Ӧ��ʧȥ�ĵ��ӵ����ʵ���Ϊ2��0.51mol=1.02mol��11.2L�����������ʵ���Ϊ0.5mol
��NO��NO2�����ʵ����ֱ�Ϊxmol��ymol����x+y=0.5��3x+y=1.02�����x=0.26��y=0.24��
NO�����=0.26mol��22.4L/mol=5.824L��5.8L���ʴ�Ϊ��5.8��
�ڼ�����������ǡ��ʹ��Һ�е�Cu2+ȫ��ת���ɳ�������ʱ��Һ������ΪNaNO3�������������غ��У�n��NaNO3��=n��NaOH��=0.5L��2.2mol/L=1.1mol����Nԭ���غ��֪��n��HNO3��=n��NaNO3��+n��NO��NO2��=1.1mol+0.5mol=1.6mol������������ʵ���Ũ��=16mol��0.14L=11.4mol/L��
�ʴ�Ϊ��11.4��
�����������ۺϲ�ѧ�����ӵļ��顢������ԭ����ʽ����д����ѧ����ʽ���㣬�Ѷ��еȣ�ע�������غ�˼����н��

��ϰ��ϵ�д�
 ��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�
��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�
�����Ŀ
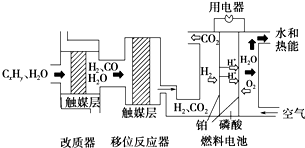 ����ȼ�ϵ����Ŀǰ��Ϊ�����ȼ�ϵ��֮һ���������ɼ���Ӧԭ����ͼ��ʾ������˵������ȷ���ǣ�������
����ȼ�ϵ����Ŀǰ��Ϊ�����ȼ�ϵ��֮һ���������ɼ���Ӧԭ����ͼ��ʾ������˵������ȷ���ǣ�������| A����ϵͳ��ֻ���ڻ�ѧ�ܺ͵��ܵ��ת�� | ||
B������λ��Ӧ���У���ӦCO��g��+H2O��g��
| ||
| C������������λ��Ӧ���������ǽ�CxHyת��ΪH2��CO2 | ||
| D���õ�������ĵ缫��ӦΪO2+4H++4e-=2H2O |
 I�����Ρ���������ʵ���ҳ��õ�ҩƷ��
I�����Ρ���������ʵ���ҳ��õ�ҩƷ��