题目内容
 溴被称为“海洋元素“.已知Br2的沸点为590C,微溶于水,有毒性和强腐性.实验室模拟从海水中提取溴的主要步骤为:
溴被称为“海洋元素“.已知Br2的沸点为590C,微溶于水,有毒性和强腐性.实验室模拟从海水中提取溴的主要步骤为:步骤1:将海水蒸发浓缩除去粗盐.
步骤2:将除去粗盐后的母液酸化后,通入适量的氯气,使Br-转化为Br2.
步骤3:向步骤2所得的水溶液中通入热空气或水蒸气,将溴单质吹入盛有二氧化硫水溶液的容器中.
步骤4:再向该容器中通入适量的氯气,使Br-转化为Br2.
步骤5:用四氯化碳萃取溴单质,经分液、蒸馏得粗溴.
(1)步骤3中热空气或水蒸气能将溴单质吹出的原因是
(2)步骤3中的反应的离子方程式:
(3)步骤2中已经制得了溴,还要进行步骤3和步骤4的原因是
(4)步骤5中萃取和分液所需要的主要玻璃仪器为
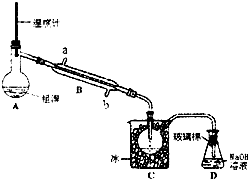
(5)用如图所示实验装置可精制粗溴.
①反应过程中需要对A容器加热,则加热的方法是
②C装置中加冰的目的是
考点:海水资源及其综合利用
专题:实验设计题
分析:(1)依据溴单质易挥发分析;
(2)步骤3中的反应是溴单质和二氧化硫在水溶液中反应生成溴化氢和硫酸;
(3)海水淡化得到的母液和电解氯化钠溶液生成的氯气反应,得到的溴单质浓度低,溴单质在水中有一定的溶解性且和水反应,提取时消耗过的能源和原料,降低了经济效益;
(4)依据萃取分液实验基本操作和装置分析需要的玻璃仪器;
(5)①反应过程中需要对A容器水浴加热,冷凝管是用来冷凝流出成分为液体,水的流向应逆流效果好;
②溴是易挥发的液体,D是氢氧化钠溶液吸收尾气防止污染空气.
(2)步骤3中的反应是溴单质和二氧化硫在水溶液中反应生成溴化氢和硫酸;
(3)海水淡化得到的母液和电解氯化钠溶液生成的氯气反应,得到的溴单质浓度低,溴单质在水中有一定的溶解性且和水反应,提取时消耗过的能源和原料,降低了经济效益;
(4)依据萃取分液实验基本操作和装置分析需要的玻璃仪器;
(5)①反应过程中需要对A容器水浴加热,冷凝管是用来冷凝流出成分为液体,水的流向应逆流效果好;
②溴是易挥发的液体,D是氢氧化钠溶液吸收尾气防止污染空气.
解答:
解:(1)步骤3中热空气或水蒸气能将溴单质吹出的原因是溴单质的沸点低,易挥发;
故答案为:溴单质的沸点低,易挥发;
(2)步骤3中的反应是溴单质和二氧化硫在水溶液中反应生成溴化氢和硫酸,反应的离子方程式为:Br2+SO2+2H2O=4H++2Br-+SO42-;
故答案为:Br2+SO2+2H2O=4H++2Br-+SO42-;
(3)步骤2中已获得Br2,步骤3中又将Br2还原为Br-,目的是低浓度的Br2溶液在提取时消耗过多的原料和能源,转化为HBr后易被氧化剂氯气氧化为溴单质,用于富集溴元素;
故答案为:步骤2氯化后,虽然含有溴单质,但浓度低,通过步骤3和4富集(浓缩)溴元素;
(4)步骤5中萃取和分液所需要的主要玻璃仪器为分液漏斗,故答案为:分液漏斗;
(5)①反应过程中需要对A容器加热,则加热的方法是水浴加热,冷凝管是用来冷凝流出成分为液体,水的流向应逆流效果好,冷却水应从B的b端通入水;
故答案为:水浴加热;b;
②C中加冰的目的是降温,减少溴的挥发,D是氢氧化钠溶液吸收尾气防止污染空气,故答案为:降温,减少溴的挥发;吸收尾气.
故答案为:溴单质的沸点低,易挥发;
(2)步骤3中的反应是溴单质和二氧化硫在水溶液中反应生成溴化氢和硫酸,反应的离子方程式为:Br2+SO2+2H2O=4H++2Br-+SO42-;
故答案为:Br2+SO2+2H2O=4H++2Br-+SO42-;
(3)步骤2中已获得Br2,步骤3中又将Br2还原为Br-,目的是低浓度的Br2溶液在提取时消耗过多的原料和能源,转化为HBr后易被氧化剂氯气氧化为溴单质,用于富集溴元素;
故答案为:步骤2氯化后,虽然含有溴单质,但浓度低,通过步骤3和4富集(浓缩)溴元素;
(4)步骤5中萃取和分液所需要的主要玻璃仪器为分液漏斗,故答案为:分液漏斗;
(5)①反应过程中需要对A容器加热,则加热的方法是水浴加热,冷凝管是用来冷凝流出成分为液体,水的流向应逆流效果好,冷却水应从B的b端通入水;
故答案为:水浴加热;b;
②C中加冰的目的是降温,减少溴的挥发,D是氢氧化钠溶液吸收尾气防止污染空气,故答案为:降温,减少溴的挥发;吸收尾气.
点评:本题考查了实验工厂分析判断,萃取分液基本操作方法,掌握物质性质和实验基本操作是解题关键,题目较简单.

练习册系列答案
相关题目
下列说法中正确的是( )
| A、含有不同种元素的纯净物叫做化合物 |
| B、水溶液中能电离出H+的化合物一定是酸 |
| C、盐中一定含有金属元素 |
| D、含有氧元素的化合物一定是氧化物 |