题目内容
设NA为阿伏加德罗常数的数值,下列叙述正确的是( )
| A、2.24LCO2中含有的原子数为0.3NA |
| B、0.1L3mol?L-1的NH4NO3溶液中含有的NH4+数目为0.3NA |
| C、5.6g铁粉与硝酸反应失去的电子数一定为0.3NA |
| D、4.5gSiO2晶体中含有的硅氧键数目为0.3NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.没有告诉在标况下,题中条件无法计算二氧化碳的物质的量;
B.铵根离子部分水解,导致溶液中铵根离子数目减少;
C.铁与稀硝酸的反应中,若硝酸不足,反应生成亚铁离子;
D.利用均摊法可知,1mol二氧化硅中含有4mol硅氧键,据此进行计算.
B.铵根离子部分水解,导致溶液中铵根离子数目减少;
C.铁与稀硝酸的反应中,若硝酸不足,反应生成亚铁离子;
D.利用均摊法可知,1mol二氧化硅中含有4mol硅氧键,据此进行计算.
解答:
解:A.不是标况下,不能使用标况下的气体摩尔体积计算2.24L二氧化碳的物质的量,故A错误;
B.0.1L3mol?L-1的NH4NO3溶液中含有溶质硝酸铵的物质的量为0.3mol,由于铵根离子部分水解,则溶液中含有的铵根离子小于0.3mol,含有的NH4+数目小于0.3NA,故B错误;
C.5.6g铁粉的物质的量为0.1mol,当硝酸足量时反应生成0.1mol铁离子,失去0.3mol电子,但稀硝酸不足时,反应可能生成亚铁离子,失去了0.2mol电子,故C错误;
D.4.5g二氧化硅的物质的量为:
=0.075mol,二氧化硅晶体中,每个Si原子与4个O原子形成了4个硅氧键,每个氧原子与两个硅原子形成了2个硅氧键,利用均摊法,每个Si原子形成的共价键数目为:
×4=2,每个O原子形成的共价键为:
×2=1,则0.75mol二氧化硅中形成的共价键的物质的量为:0.075mol×(2+1×2)=0.3mol,含有的硅氧键数目为0.3NA,故D正确;
故选D.
B.0.1L3mol?L-1的NH4NO3溶液中含有溶质硝酸铵的物质的量为0.3mol,由于铵根离子部分水解,则溶液中含有的铵根离子小于0.3mol,含有的NH4+数目小于0.3NA,故B错误;
C.5.6g铁粉的物质的量为0.1mol,当硝酸足量时反应生成0.1mol铁离子,失去0.3mol电子,但稀硝酸不足时,反应可能生成亚铁离子,失去了0.2mol电子,故C错误;
D.4.5g二氧化硅的物质的量为:
| 4.5g |
| 60g/mol |
| 1 |
| 2 |
| 1 |
| 2 |
故选D.
点评:本题考查了阿伏伽德罗常数的判断,题目难度中等,注意掌握物质的量与阿伏伽德罗常数、摩尔质量、气体摩尔体积的转化关系,明确标况下气体摩尔体积的使用条件,选项D为易错点,注意均摊法的应用.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
镁铝合金6.3g完全溶于稀硝酸,若反应中硝酸被还原只产生4.48L(标准状况下)NO气体,在反应后的溶液中,加入足量1mol?L-1的NaOH溶液,生成沉淀的质量为( )
| A、8.7 g |
| B、7.8 g |
| C、16.5 g |
| D、4.0g |
某NaCl和CaCl2的混合溶液中,c(Ca2+)=0.2mol?L-1,c(Cl-)=0.7mol?L-1,那么c(Na+)为( )
| A、0.1 mol?L-1 |
| B、0.2 mol?L-1 |
| C、0.3 mol?L-1 |
| D、0.4 mol?L-1 |
下列说法中正确的是( )
| A、含有不同种元素的纯净物叫做化合物 |
| B、水溶液中能电离出H+的化合物一定是酸 |
| C、盐中一定含有金属元素 |
| D、含有氧元素的化合物一定是氧化物 |
下列试剂存放的方法正确的是( )
| A、少量白磷保存在二硫化碳中 |
| B、金属钠保存在四氯化碳中 |
| C、液溴保存在少量冷水中 |
| D、氢氟酸保存在玻璃瓶中 |
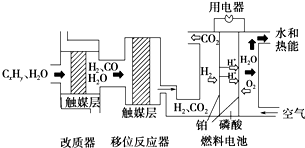 磷酸燃料电池是目前较为成熟的燃料电池之一,其基本组成及反应原理如图所示.下列说法不正确的是( )
磷酸燃料电池是目前较为成熟的燃料电池之一,其基本组成及反应原理如图所示.下列说法不正确的是( )| A、该系统中只存在化学能和电能的相互转化 | ||
B、在移位反应器中,反应CO(g)+H2O(g)
| ||
| C、改质器和移位反应器的作用是将CxHy转化为H2和CO2 | ||
| D、该电池正极的电极反应为O2+4H++4e-=2H2O |
溶液和胶体具备的共同性质是( )
| A、分散质微粒都能透过半透膜 |
| B、用石墨电极做导电性实验时,分散质微粒都定向且朝一个方向移动 |
| C、都有丁达尔现象 |
| D、都比较稳定 |