题目内容
向25mL,18mol?L-1的硫酸溶液中加入足量铜片并加热,充分反应后,求被还原的硫酸的物质的量 .
考点:氧化还原反应的计算
专题:
分析:发生反应:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,由方程式可知,被还原的硫酸的物质的量是参加反应的硫酸的一半,但随着反应的进行,硫酸的浓度逐渐降低,而铜与稀硫酸并不反应,因此,被还原的硫酸的物质的量应小于参加反应硫酸的一半.
| ||
解答:
解:浓硫酸中n(H2SO4)=0.025L×18mol/L=0.45mol,
发生反应:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,若硫酸完全反应,由方程式可知,被还原的硫酸的物质的量是参加反应的硫酸的一半,被还原硫酸为0.45mol×
=0.225mol,但随着反应的进行,硫酸的浓度逐渐降低,而铜与稀硫酸并不反应,因此,被还原的硫酸的物质的量应小于0.225mol,
故答案为:小于0.225mol.
发生反应:Cu+2H2SO4(浓)
| ||
| 1 |
| 2 |
故答案为:小于0.225mol.
点评:本题考查氧化还原反应计算、浓硫酸的性质,难度不大,注意铜与浓硫酸在加热条件下能发生反应,铜与稀硫酸不反应.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是( )
| A、36gH2O和22.4LCO2中Si和O,C和O之间的共价键均是4×6.02×1023 |
| B、0.1 L 3 mol?L-1的NH4NO3溶液中含有的NH4+数目为0.3×6.02×1023 |
| C、常温常压下,4.6 g NO2气体含有0.1×6.02×1023个NO2分子 |
| D、0.1 mol的甲基(-CH3)和羟基(-OH)所含电子数均为0.9×6.02×1023 |
某溶液中投入铝片可放出氢气,则该溶液可能存在的离子组是( )
| A、Fe2+、Cl-、NO3-、Na+、Al3+ |
| B、Mg2+、Ba2+、SO42-、Cl-、Al3+ |
| C、H+、Cl-、SO42-、K+、Al3+ |
| D、Na+、K+、SO42-、OH-、Al3+ |
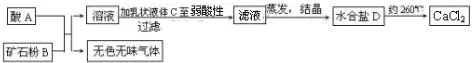
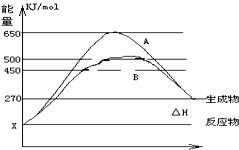 (1)已知:Fe(s)+
(1)已知:Fe(s)+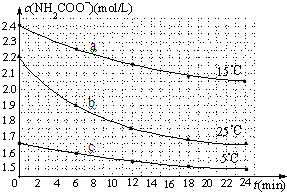 某研究小组在实验室探究氨基甲酸铵(H2NCOONH4)水解反应速率的测定和分解反应平衡常数.
某研究小组在实验室探究氨基甲酸铵(H2NCOONH4)水解反应速率的测定和分解反应平衡常数.