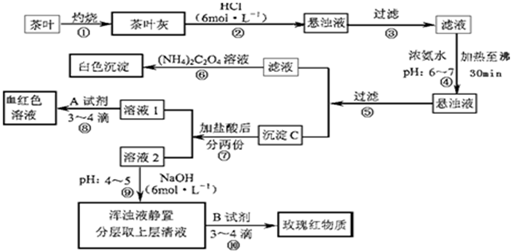
题目内容
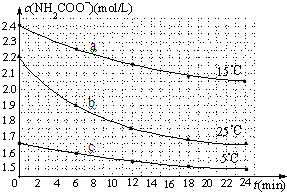 某研究小组在实验室探究氨基甲酸铵(H2NCOONH4)水解反应速率的测定和分解反应平衡常数.
某研究小组在实验室探究氨基甲酸铵(H2NCOONH4)水解反应速率的测定和分解反应平衡常数.(1)已知:H2NCOONH4+2H2O?NH4HCO3+NH3?H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(H2NCOO-)随时间变化趋势如图所示.
①25℃时,0~6min氨基甲酸铵水解反应的平均速率为
②对比如图中哪两条曲线,能得出“水解反应速率随温度升高而增大”的结论?
(2)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:H2NCOONH4(s)?2NH3(g)+CO2(g).实验测得不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度 (×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.单位时间内生成1mol CO2的同时消耗2mol NH3
B.容器内气体压强保持不变
C.容器中CO2与NH3的物质的量之比保持不变
D.容器中混合气体的密度保持不变
④根据表中数据计算,15.0℃时的分解平衡常数(Kc)为
⑤氨基甲酸铵分解反应属于
⑥氨基甲酸铵分解反应的熵变△S
考点:化学平衡的计算,化学平衡的影响因素,化学平衡状态的判断
专题:
分析:(1)①根据化学反应速率的公式来计算;
②由图象数据可以得出,用不同初始浓度,不同温度下的平均速率的大小来说明.
(2)③根据化学平衡的标志来判断;
④先根据反应 NH2COONH4(s)?2NH3(g)+CO2(g),可知平衡时容器内气体的浓度之比为2:1,由总浓度求出NH3、CO2 的平衡浓度,最后代入平衡常数的表达式来计算;
⑤根据表中数据判断随着温度升高,平衡移动的方向,从而判断出正反应是吸热还是放热;
⑥根据气态物质的熵大于液态物质的熵判断出熵变;
②由图象数据可以得出,用不同初始浓度,不同温度下的平均速率的大小来说明.
(2)③根据化学平衡的标志来判断;
④先根据反应 NH2COONH4(s)?2NH3(g)+CO2(g),可知平衡时容器内气体的浓度之比为2:1,由总浓度求出NH3、CO2 的平衡浓度,最后代入平衡常数的表达式来计算;
⑤根据表中数据判断随着温度升高,平衡移动的方向,从而判断出正反应是吸热还是放热;
⑥根据气态物质的熵大于液态物质的熵判断出熵变;
解答:
解:(1)①化学反应速率V=
=
=0.05mol/(L?min),故答案为:0.05mol/(L?min);
②因25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大,
故答案为:25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大.
(2)③A、单位时间内生成1mol CO2相当于生成2mol NH3同时消耗2mol NH3,则正逆反应速率相等,故A正确;
B、该反应是气体体积增大的反应,故当容器内压强不变时,已达到平衡,故B正确;
C、因反应物(NH2COONH4)是固体物质,所以CO2与NH3的物质的量之比,为1:2,故C错误;
D、该反应是气体质量增大的反应,故当密闭容器中混合气体的密度不变,已达到平衡,故D正确;
故选:ABD;
④15.0℃时,总浓度为2.4×10-3 mol/L,容器内气体的浓度之比为2:1,故NH3和CO2的浓度分别为1.6×10-3 mol/L、0.8×10-3 mol/L,代入平衡常数表达式:K=(1.6×10-3)2×0.8×10-3 =2.048×10-9,故答案为:2.048×10-9;
⑤从表中数据可以看出,随着温度升高,气体的总浓度增大,平衡正向移动,则该反应为吸热反应,△H>0;故答案为:吸热;随着温度升高,平衡气体浓度增大;
⑥反应中固体变为气体,混乱度增大,△S>0,故答案为:>;
| △c |
| △t |
| 2.2mol/L-1.9mol/L |
| 6min |
②因25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大,
故答案为:25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大.
(2)③A、单位时间内生成1mol CO2相当于生成2mol NH3同时消耗2mol NH3,则正逆反应速率相等,故A正确;
B、该反应是气体体积增大的反应,故当容器内压强不变时,已达到平衡,故B正确;
C、因反应物(NH2COONH4)是固体物质,所以CO2与NH3的物质的量之比,为1:2,故C错误;
D、该反应是气体质量增大的反应,故当密闭容器中混合气体的密度不变,已达到平衡,故D正确;
故选:ABD;
④15.0℃时,总浓度为2.4×10-3 mol/L,容器内气体的浓度之比为2:1,故NH3和CO2的浓度分别为1.6×10-3 mol/L、0.8×10-3 mol/L,代入平衡常数表达式:K=(1.6×10-3)2×0.8×10-3 =2.048×10-9,故答案为:2.048×10-9;
⑤从表中数据可以看出,随着温度升高,气体的总浓度增大,平衡正向移动,则该反应为吸热反应,△H>0;故答案为:吸热;随着温度升高,平衡气体浓度增大;
⑥反应中固体变为气体,混乱度增大,△S>0,故答案为:>;
点评:本题是一道考查化学反应速率概念及其计算,化学平衡、化学平衡常数的概念及其计算,以及判断反应的焓变、熵变等相关知识的试题,要求考生利用图表、进行数据分析判断,吸收、提取有效信息,突出了化学信息运用能力的考查.同时,对于作为化学的基本技能之一的化学计算,渗透在相关的知识块之中,强调计算的实用性以及认识、解决问题的综合性.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
近年来,我国首都--北京市的部分公交车已改用天然气作燃料,这样做的主要目的是( )
| A、降低成本 |
| B、加大发动机动力 |
| C、减少CO2的排放量 |
| D、减少对空气的污染 |

 已知单质A、B、C和甲、乙、丙、丁四种化合物有图示的转换关系,甲是一种高熔点的物质.丙常温下是一种液体.根据图示转化关系回答:
已知单质A、B、C和甲、乙、丙、丁四种化合物有图示的转换关系,甲是一种高熔点的物质.丙常温下是一种液体.根据图示转化关系回答: