题目内容
8.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图1表示该反应进行过程中能量(单位为kJ•mol-1)的变化.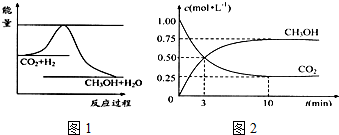
(1)由图可知,该反应的△H<0 (填“>”、“<”、“=”);
(2)为探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示.
①反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)=0.225mol•L-1•min-1;
②下列措施中能使平衡时$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大的有D.
A.升高温度 B.加入催化剂 C.充入He(g),使体系总压强增大
D.将H2O(g)从体系中分离 E.再充入1mol CO2
(3)该反应平衡常数K的表达式为:$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{c(C{O}_{2})•{c}^{3}({H}_{2})}$; 反应达平衡时,保持其他条件不变,从体系中分离出部分甲醇,平衡常数K将不变(填“变大”、“变小”、“不变”).
分析 (1)由图1可知,反应物总能量大于生成物总能量,反应为放热反应;
(2)①由图2可知,甲醇的浓度变化量为0.75mol/L,根据v=$\frac{△c}{△t}$计算v(CH3OH),再利用速率之比等于化学计量数之比计算v(H2);
②使$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大,改变条件使平衡向正反应移动,但只增大二氧化碳的浓度会使该比值减小;
(3)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
平衡常数只受温度影响,温度不变,平衡常数不变.
解答 解:(1)由图1可知,反应物的总能量高于生成物的总能量,该反应为放热反应,即△H<0,
故答案为:<;
(2)①由图2可知,10min达平衡时甲醇的浓度变化量为0.75mol/L,所以v(CH3OH)=$\frac{0.75mol/L}{10min}$=0.075mol/(L•min),速率之比等于化学计量数之比,所以v(H2)=3v(CH3OH)=3×0.075mol/(L•min)=0.225mol/(L•min);
故答案为:0.225;
②使$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大,改变条件使平衡向正反应移动,但只增大二氧化碳的浓度会使该比值减小
A.正反应为放热反应,升高温度,平衡向逆反应移动,$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$减小,故A错误;
B.加入催化剂,平衡不移动,$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$不变,故B错误;
C.充入He(g),反应混合物的浓度不变,平衡不移动,$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$不变,故C错误;
D.将H2O(g)从体系中分离,平衡向正反应移动,$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大,故D正确;
E.再充入1mol CO2,平衡虽然向正反应移动,但平衡时$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$减小,故E错误;
故选D.
(3)可逆反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的化学平衡常数k=$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{c(C{O}_{2})•{c}^{3}({H}_{2})}$,平衡常数只受温度影响,温度不变,平衡常数不变,
故答案为:$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{c(C{O}_{2})•{c}^{3}({H}_{2})}$;不变.
点评 本题考查平衡图象、化学平衡有关计算、反应速率、化学平衡及影响因素等,难度不大,注意基础知识的理解掌握,(2)中②只增大二氧化碳的浓度会使该比值减小,可以借助平衡常数分析理解.

| A. | 非金属性:N>P>As>Sb>Bi | B. | 酸性:HNO3>H3PO4>H3AsO4>H3SbO4 | ||
| C. | 稳定性:NH3<PH3<AsH3<SbH3 | D. | 稳定性:HCl>H2S>PH3>SiH4 |
| A. | 氯化铝与氨水反应:Al3++3OH-═Al(OH)3↓ | |
| B. | 稀硫酸与氢氧化钡溶液反应:H++OH-+Ba2++SO42-═H2O+BaSO4↓ | |
| C. | 碳酸钙与稀盐酸反应:CO32--+2H+═H2O+CO2↑ | |
| D. | 向苏打溶液中加入足量的醋酸:CO32-+2CH3COOH═CO2↑+H2O+2CH3COO- |
| A. | 单位时间内生成2n mol X,同时消耗nmol Y | |
| B. | X的生成速率与Z的生成速率相等 | |
| C. | X、Y、Z的浓度相等 | |
| D. | 容器内气体的压强不再变化 |
| A. | 高温加热 | B. | 紫外线照射 | C. | 加食盐水 | D. | 加福尔马林 |
| A. | Al-Al2O3-Al(OH)3-NaAlO2 | B. | S-SO3-H2SO4-MgSO4 | ||
| C. | Mg-MgCl2-Mg(OH)2-MgO | D. | Si-SiO2-H2SiO3-Na2 SiO3 |
| A. | 114号元素在周期表中第七周期第VIA族,属于金属元素 | |
| B. | 晶体硅熔点高硬度大,可用于制作光导纤维 | |
| C. | 为了除去MgCl2酸性溶液中的Fe3+而得到较纯净的MgCl2溶液,可在加热搅拌的条件下加入MgCO3,过滤后,再向滤液中加入适量的盐酸 | |
| D. | 光束通过下列分散系①有尘埃的空气②明矾溶液③墨水④稀豆浆时,都能产生丁达尔效应 |