题目内容
3.一定温度下,在恒容容器中,反应2X(g)+Y(g)?3Z(g)达到限度的标志是( )| A. | 单位时间内生成2n mol X,同时消耗nmol Y | |
| B. | X的生成速率与Z的生成速率相等 | |
| C. | X、Y、Z的浓度相等 | |
| D. | 容器内气体的压强不再变化 |
分析 化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再发生变化,由此衍生的一些物理量不再变化,注意该反应化学方程式中气体的化学计量数之和相等的特点,以此进行判断.
解答 解:A.单位时间内生成3nmolX,同时消耗nmolY,可说明正逆反应速率相等,达到平衡状态,故A正确;
B.X的生成速率与Z的生成速率相等,则正逆反应速率不等,没有达到平衡状态,故B错误;
C.平衡时各物质的浓度取决于反应开始时的配料比以及反应转化的程度,不能用来判断是否达到平衡状态,故C错误;
D.该反应前后气体体积不变,反应过程中压强不变,不能用压强判断是否达到平衡状态,故D错误;
故选A.
点评 本题考查化学平衡状态的判断,题目难度不大,明确化学平衡状态的特征为解答关键,注意掌握影响化学平衡的因素,试题培养了学生的灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.铜和镁的合金4.7克完全溶于浓硝酸中,若反应中硝酸被还原只产生4480mL的NO2气体和336mL的N2O4气体(都已经折算成标准状况).在反应后的溶液中加入足量的NaOH溶液,生成沉淀的质量为( )
| A. | 9.02g | B. | 8.26g | C. | 8.61g | D. | 7.04g |
11.下列说法正确的是( )
| A. | BaSO4难溶于水,但BaSO4是电解质 | |
| B. | 铜和石墨均能导电,所以它们都是电解质 | |
| C. | 电解质一定能导电,能导电的物质不一定属于电解质 | |
| D. | 液态HCl不导电,所以HCl不是电解质 |
12.已知碳酸钙的分解
①CaCO3(s)═CaO(s)+CO2(g)仅在高温下自发:氯酸钾的分解
②2KClO3(s)═2KCl(s)+3O2(g)在任何温度下都自发,下面有几组焓变数据,其中可能正确的是( )
①CaCO3(s)═CaO(s)+CO2(g)仅在高温下自发:氯酸钾的分解
②2KClO3(s)═2KCl(s)+3O2(g)在任何温度下都自发,下面有几组焓变数据,其中可能正确的是( )
| A. | △H1=-178.32kJ•mol-1△H2=+78.3kJ•mol-1 | |
| B. | △H1=+178.32kJ•mol-1△H2=-78.3kJ•mol-1 | |
| C. | △H1=-178.32kJ•mol-1△H2=+78.3kJ•mol-1 | |
| D. | △H1=+178.32kJ•mol-1△H2=+78.3kJ•mol-1 |
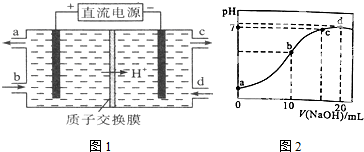

 .
.