题目内容
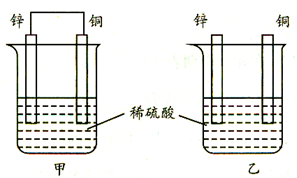 将纯铜片和纯锌片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
将纯铜片和纯锌片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )| A、两烧杯中铜片表面均无气泡产生 |
| B、甲中铜片是正极,电极反应:2H++2e→H2↑;乙中锌片是负极,电极反应:Zn-2e→Zn2+ |
| C、两烧杯中的pH值均增大 |
| D、产生的气泡速率甲比乙慢 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:甲装置构成原电池,锌为负极、Cu为正极,负极反应式为Zn-2e-→Zn2+,正极反应式为2H++2e-→H2↑;乙不能构成闭合回路,所以不能形成原电池,锌和稀硫酸发生化学腐蚀生成硫酸锌和氢气,据此分析解答.
解答:
解:A.甲构成原电池,铜片作正极,正极反应式为2H++2e-→H2↑,所以铜片有气泡生成;乙中不能构成原电池,铜片和稀硫酸不反应,所以铜片上没有气泡产生,故A错误;
B.乙不能构成闭合回路,所以不能形成原电池,故B错误;
C.两个烧杯中氢离子都得电子生成氢气,所以氢离子浓度减小,溶液的pH增大,故C正确;
D.原电池能加快金属腐蚀速率,所以甲产生气泡速率大于乙,故D错误;
故选C.
B.乙不能构成闭合回路,所以不能形成原电池,故B错误;
C.两个烧杯中氢离子都得电子生成氢气,所以氢离子浓度减小,溶液的pH增大,故C正确;
D.原电池能加快金属腐蚀速率,所以甲产生气泡速率大于乙,故D错误;
故选C.
点评:本题考查原电池原理,侧重原电池构成条件判断、电极反应等知识点的考查,虽然两个装置不同,但甲中电池反应式与乙中方程式相同,题目难度不大.

练习册系列答案
相关题目
X、Y、Z、W是元素周期表前四周期中的常见元素.其相关信息如表:下列说法正确的是( )
| 元素 | 相关信息 |
| X | X的一种核素的质量数为14,中子数为8 |
| Y | Y与X同周期,且它的一种氧化物只能用排水法收集 |
| Z | Z的单质常温下为黄绿色气体 |
| W | W的原子核外电子总数是其电子层数的4倍 |
| A、原子半径:W>X>Y,离子半径:W>Z |
| B、氧化物对应的水化物的酸性:Z>Y>X |
| C、Y的最高正价含氧酸,可由它的氢化物为原料来制取 |
| D、W的单质与X的一种氧化物不能发生置换反应 |
除去镁粉中的少量铝粉,可选用( )
| A、硫酸 | B、氨水 |
| C、盐酸 | D、氢氧化钠溶液 |
高温下,某反应达到平衡,平衡常数K=
.恒容时,温度升高,H2浓度减小.下列说法正确的是( )
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| A、该反应是焓变为负值 | |||
| B、其它条件不变,缩小容器体积,H2浓度一定增大 | |||
| C、升高温度,正反应速率增大,逆反应速率减小 | |||
D、该反应化学方程式为CO+H2O
|
合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
| A、增大CO的浓度 | B、降低温度 |
| C、升高温度 | D、增大压强 |
下列叙述中正确的是( )
| A、原电池跟电解池连接后,电子从电池负极流向电解池阳极 |
| B、合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| C、无隔膜电解饱和NaCl溶液所得产物之一是“84”消毒液中的有效成分 |
| D、工业上铜的电解精炼时电解池中每转移1mol电子时阴极析出的铜小于0.5NA |
下列说法正确的是( )
| A、干粉(含NaHCO3)灭火剂能扑灭钠着火 |
| B、Na2O2中阳离子和阴离子的个数比为1:1 |
| C、Na2CO3和NaHCO3都能跟CaCl2溶液反应得到白色沉淀 |
| D、物质灼烧时焰色反应为黄色,该物质一定含有钠元素 |
下列反应中,属于氧化还原反应的是( )
| A、2Na2O2+2CO2═2Na2CO3+O2 |
| B、Na2O+CO2═Na2CO3 |
| C、2NaOH+CO2═Na2CO3+H2O |
| D、CaCO3═CaO+CO2↑ |
