题目内容
下列说法正确的是( )
| A、干粉(含NaHCO3)灭火剂能扑灭钠着火 |
| B、Na2O2中阳离子和阴离子的个数比为1:1 |
| C、Na2CO3和NaHCO3都能跟CaCl2溶液反应得到白色沉淀 |
| D、物质灼烧时焰色反应为黄色,该物质一定含有钠元素 |
考点:钠的重要化合物,钠的化学性质
专题:元素及其化合物
分析:A.钠着火时生成过氧化钠,而过氧化钠能与水、二氧化碳发生反应生成氧气;
B.过氧化钠是由2个钠离子与1个过氧根离子通过离子键结合形成的离子化合物;
C.依据离子反应发生的条件判断;
D.钠元素的焰色为黄色.
B.过氧化钠是由2个钠离子与1个过氧根离子通过离子键结合形成的离子化合物;
C.依据离子反应发生的条件判断;
D.钠元素的焰色为黄色.
解答:
解:A.钠着火时生成过氧化钠,而过氧化钠能与水、二氧化碳发生反应生成氧气,而干冰灭火器产生二氧化碳,所以不能扑灭,故A错误;
B.Na2O2中阳离子和阴离子的个数比为2:1,故B错误;
C.Na2CO3和NaHCO3不符合离子反应条件,不会发生反应,Na2CO3和CaCl2溶液反应生成碳酸钙沉淀,故C错误;
D.焰色反应为元素的性质,不同的金属灼烧产生不同的焰色,钠元素的焰色为黄色,故D正确;
故选:D.
B.Na2O2中阳离子和阴离子的个数比为2:1,故B错误;
C.Na2CO3和NaHCO3不符合离子反应条件,不会发生反应,Na2CO3和CaCl2溶液反应生成碳酸钙沉淀,故C错误;
D.焰色反应为元素的性质,不同的金属灼烧产生不同的焰色,钠元素的焰色为黄色,故D正确;
故选:D.
点评:本题考查了钠及其化合物,题目难度不大,熟悉钠、过氧化钠、碳酸钠、碳酸氢钠的结构和性质是解题关键,注意焰色反应为物理性质.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
在蒸发发皿中加热蒸干并灼烧(低于400℃)下列溶液,可以得到原溶质物质的固体是( )
| A、氯化铝溶液 |
| B、碳酸氢钠溶液 |
| C、硫酸镁溶液 |
| D、高锰酸钾溶液 |
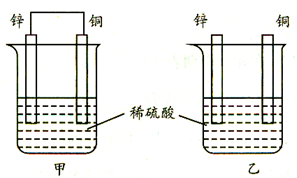 将纯铜片和纯锌片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
将纯铜片和纯锌片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )| A、两烧杯中铜片表面均无气泡产生 |
| B、甲中铜片是正极,电极反应:2H++2e→H2↑;乙中锌片是负极,电极反应:Zn-2e→Zn2+ |
| C、两烧杯中的pH值均增大 |
| D、产生的气泡速率甲比乙慢 |
下列说法中,不正确的是( )
| A、金属的冶炼,就是利用氧化还原反应原理,在一定条件下将金属从其化合物中还原出来 |
| B、冶炼金属时,必须加入一种物质作为还原剂 |
| C、金属由化合态变为游离态,都是被还原 |
| D、金属单质被发现和应用得越早,其活动性一般越弱 |
下列物质性质与应用对应关系正确的是( )
| A、漂白粉在空气中不稳定,可用于漂白纸张 |
| B、医用酒精能使蛋白质变性,可用于消毒杀菌 |
| C、二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 |
| D、铜的金属活泼性比铁的弱,可在铁闸上装若干铜块以减缓其腐蚀 |
关于下列各图的叙述错误的是 ( )


| A、已知1molCO燃烧放出的热为283kJ,2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol则图甲表示CO和H2O(g)生成CO2和H2的能量变化 | ||
| B、常温下0.4 mol?L-1 HB溶液和0.2 mol?L-1NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(B-)>c(Na+)>c(H+)>c(OH-) | ||
| C、常温下,X2(g)和H2反应生成HX的平衡常数如表乙所示,仅依据K的变化,就可以说明在相同条件下,平衡时X2(从F2到I2)的转化率逐渐减小,且HX的还原性逐渐减弱 | ||
D、图丙中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,
|
医疗上颇为流行的“理疗特效热”,就是利用铁缓慢氧化放出均匀.稳定的热,使患者患处保持温热状态.若1mol铁粉完全氧化成氧化铁,需消耗氧气的质量为( )
| A、24g |
| B、32 g |
| C、21 g |
| D、16 g |
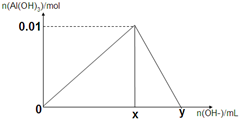 将3mol/L NaOH溶液滴入到25mL一定浓度的AlCl3溶液中.如图是整个过程的数学分析曲线.其中横轴表示加入OH-的体积,纵轴表示产生的Al(OH)3沉淀物质的量.据图示回答下列问题:
将3mol/L NaOH溶液滴入到25mL一定浓度的AlCl3溶液中.如图是整个过程的数学分析曲线.其中横轴表示加入OH-的体积,纵轴表示产生的Al(OH)3沉淀物质的量.据图示回答下列问题: