题目内容
下列反应中,属于氧化还原反应的是( )
| A、2Na2O2+2CO2═2Na2CO3+O2 |
| B、Na2O+CO2═Na2CO3 |
| C、2NaOH+CO2═Na2CO3+H2O |
| D、CaCO3═CaO+CO2↑ |
考点:氧化还原反应
专题:氧化还原反应专题
分析:氧化还原反应的特征是元素化合价的升降,发生氧化还原反应,一定存在元素化合价的变化,以此解答.
解答:
解:A.O元素化合价发生变化,属于氧化还原反应,故A正确;
B.反应前后各元素的化合价不变,不属于氧化还原反应,故B错误;
C.反应前后各元素的化合价不变,不属于氧化还原反应,故C错误;
D.反应前后各元素的化合价不变,不属于氧化还原反应,故D错误.
故选A.
B.反应前后各元素的化合价不变,不属于氧化还原反应,故B错误;
C.反应前后各元素的化合价不变,不属于氧化还原反应,故C错误;
D.反应前后各元素的化合价不变,不属于氧化还原反应,故D错误.
故选A.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,注意化合价的原则及常见元素的化合价,题目难度不大.

练习册系列答案
 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
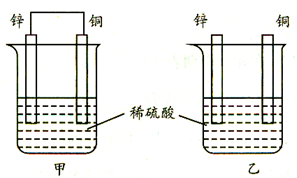 将纯铜片和纯锌片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
将纯铜片和纯锌片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )| A、两烧杯中铜片表面均无气泡产生 |
| B、甲中铜片是正极,电极反应:2H++2e→H2↑;乙中锌片是负极,电极反应:Zn-2e→Zn2+ |
| C、两烧杯中的pH值均增大 |
| D、产生的气泡速率甲比乙慢 |
下列物质性质与应用对应关系正确的是( )
| A、漂白粉在空气中不稳定,可用于漂白纸张 |
| B、医用酒精能使蛋白质变性,可用于消毒杀菌 |
| C、二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 |
| D、铜的金属活泼性比铁的弱,可在铁闸上装若干铜块以减缓其腐蚀 |
关于下列各图的叙述错误的是 ( )


| A、已知1molCO燃烧放出的热为283kJ,2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol则图甲表示CO和H2O(g)生成CO2和H2的能量变化 | ||
| B、常温下0.4 mol?L-1 HB溶液和0.2 mol?L-1NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(B-)>c(Na+)>c(H+)>c(OH-) | ||
| C、常温下,X2(g)和H2反应生成HX的平衡常数如表乙所示,仅依据K的变化,就可以说明在相同条件下,平衡时X2(从F2到I2)的转化率逐渐减小,且HX的还原性逐渐减弱 | ||
D、图丙中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,
|
一定条件下,在体积固定的密闭容器中通入2.0mol SO2、1.2mol O2,发生反应2SO2(g)+O2(g)═
2SO3(g)△H=-198kJ?mol -1,下列判断不正确的是( )
2SO3(g)△H=-198kJ?mol -1,下列判断不正确的是( )
| A、2SO2(g)+O2(g)═2SO3(s)△H<-198kJ?mol-1 |
| B、增加反应物的量不能改变上述反应的△H |
| C、充分反应后,放出的热量小于198 kJ |
| D、若从反应开始到建立平衡放出热量158.4 kJ,则SO2的平衡转化率为60% |
下列说法中错误的是( )
| A、金属晶体的四种堆积模型中,六方最密堆积和面心立方最密堆积的空间利用率最高 |
| B、通过手性合成的方法,可以只得到一种或者主要只得到一种手性分子 |
| C、金刚石的网状结构中,由共价键形成的最小碳环上有6个碳原子 |
| D、分子形成氢键一定使物质的熔沸点升高 |
医疗上颇为流行的“理疗特效热”,就是利用铁缓慢氧化放出均匀.稳定的热,使患者患处保持温热状态.若1mol铁粉完全氧化成氧化铁,需消耗氧气的质量为( )
| A、24g |
| B、32 g |
| C、21 g |
| D、16 g |
下列离子反应方程式中,书写正确的是( )
| A、明矾溶液加入偏铝酸钠溶液:Al3++3AlO2-+6H2O═4Al(OH)3↓ |
| B、氯化铁溶液与适量铜粉混合:Cu+Fe3+═Cu2++Fe2+ |
| C、Fe3O4固体溶于足量稀硝酸溶液中:Fe3O4+8H+═2Fe3++Fe2++4H2O |
| D、碳酸氢铵溶液与足量澄清石灰水溶液混合:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O |