题目内容
1.(1)常温下,用0.1000mol•L-1NaOH溶液滴定20.00mL0.100 0mol•L-1CH3COOH溶液所得滴定曲线如图1.已知起始①点溶液的pH为3,③点溶液的pH为7,则Ka(CH3COOH)=10-5.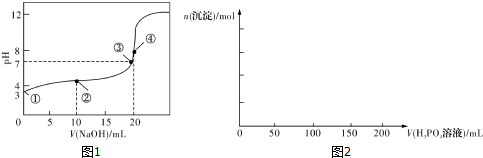
(2)在用Na2SO3溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 1:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
(3)向0.1mol•L-1的NaHSO3中通人氨气至溶液呈中性时,溶液中的c(H+)、c(OH-)、c(SO32-)、c(Na+)、c(NH4+)这五种离子浓度大小关系是c(Na+)>c(SO32-)>c(NH4+)>c(H+)=c(OH-).
(4)已知Ca3(PO4)2、CaHPO4均难溶于水,而Ca(H2PO4)2易溶,在含0.1molCa(OH)2的澄清石灰水中逐滴加人1mol•L-1的H3PO4:请在图2中作出生成沉淀的物质的量随H3PO4滴人体积从0开始至200mL的图象.
分析 (1)根据图象可知,起始①点溶液的pH为3,溶液中氢离子浓度为10-3mol/L,此时为0.1000mol/L的CH3COOH溶液,由于醋酸的电离程度较小,则醋酸根离子浓度约为10-3mol/L、醋酸的浓度约为0.1mol/L,将该数据代入醋酸的平衡常数表达式即可;
(2)由表中数据可知,溶液中n(SO32-):n(HSO3-)=1:1时,溶液pH=7.2,且比值越大,溶液的碱性越强,故吸收液呈中性时应n(SO32-):n(HSO3-)<1:1,溶液呈中性有c(H-)=c(OH-),结合电荷守恒有c(Na+)=2c(SO32-)+c(HSO3-),据此判断;
(3)液呈中性时,c(H+)=c(OH-),根据电荷守恒可知:c(Na+)+c(NH4+)=2c(SO32-),由于钠离子浓度大于亚硫酸根离子,则c(Na+)>c(SO32-)>c(NH4+);
(4)当加入$\frac{1}{15}$mol H3PO4时恰好生成Ca3(PO4)2,加入1mol•L-1的H3PO4溶液的体积为:$\frac{\frac{1}{15}mol}{1mol/L}$=0.067L=66.7mL;当加入0.1mol H3PO4时恰好生成CaHPO4,此时沉淀达到最大,消耗H3PO4溶液的体积为:$\frac{0.1mol}{1mol/L}$=0.1L=100mL;之后沉淀逐渐溶解,当加入0.1molH3PO4时沉淀完全溶解,消耗H3PO4溶液的体积为:$\frac{0.2mol}{1mol/L}$=0.2L=200mL,据此画出图象.
解答 解:(1)起始①点溶液的pH为3,此时为0.1000mol/L的CH3COOH溶液,溶液中氢离子浓度为10-3mol/L,醋酸根离子浓度约为10-3mol/L,醋酸的浓度约为0.1mol/L,则醋酸的电离平衡常数为:$\frac{1{0}^{-3}×1{0}^{-3}}{0.1}$=10-5,
故答案为:10-5;
(2)由表中数据可知,溶液中n(SO32-):n(HSO3-)=1:1时,溶液pH=7.2,且比值越大,溶液的碱性越强,故吸收液呈中性时应n(SO32-):n(HSO3-)<1:1,即c(HSO3-)>c(SO32-),溶液呈中性有c(H-)=c(OH-),结合电荷守恒推出c(Na+)=2c(SO32-)+c(HSO3-),故溶液中c(Na+)>c(HSO3-),所以溶液中c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-),
故答案为:c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-);
(3)向0.1mol•L的NaHSO3中通入氨气至溶液呈中性时,c(H+)=c(OH-),根据电荷守恒可知:c(Na+)+c(NH4+)=2c(SO32-),由于钠离子浓度大于亚硫酸根离子,则c(Na+)>c(SO32-)>c(NH4+),所以溶液中c(H+)、c(OH-)、c(SO32-)、c(Na+)、c(NH4+)这五种离子浓度大小关系为:c(Na+)>c(SO32-)>c(NH4+)>c(H+)=c(OH-),
故答案为:c(Na+)>c(SO32-)>c(NH4+)>c(H+)=c(OH-);
(4)在含0.1mol Ca(OH)2的澄清石灰水中逐渐加入1mol•L-1的H3PO4,当加入$\frac{1}{15}$mol H3PO4时恰好生成Ca3(PO4)2,加入1mol•L-1的H3PO4溶液的体积为:$\frac{\frac{1}{15}mol}{1mol/L}$=0.067L=66.7mL;当加入0.1mol H3PO4时恰好生成CaHPO4,此时沉淀达到最大,消耗H3PO4溶液的体积为:$\frac{0.1mol}{1mol/L}$=0.1L=100mL;之后沉淀逐渐溶解,当加入0.1molH3PO4时沉淀完全溶解,消耗H3PO4溶液的体积为:$\frac{0.2mol}{1mol/L}$=0.2L=200mL,据此画出成沉淀的物质的量随H3PO4滴入体积从0开始至200mL的图象为: ,
,
故答案为: .
.
点评 本题考查了离子浓度大小比较,为高频考点,涉及电离平衡常数的计算、离子浓度大小比较及绘画反应图象等知识,注意掌握电离平衡常数的概念及计算方法,明确电荷守恒、盐的水解原理、物料守恒在判断离子浓度大小中的应用方法,题目难度中等.

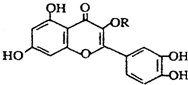
| A. | 若R为甲基则该物质的分子式可以表示为C16H10O7 | |
| B. | 分子中有三个苯环 | |
| C. | lmol该化合物与NaOH溶液作用消耗NaOH的物质的量以及与氢气加成所需的氢气的物质的量分别是4 mol、8 mol | |
| D. | lmol该化合物最多可与7molBr2完全反应 |
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至指示剂恰好变色,且30分钟不变化,测得所耗盐酸的体积为V1mL;
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL.
试回答下列问题:
(1)锥形瓶中的溶液从红色变为无色时,停止滴定.
(2)滴定时边滴边摇动锥形瓶,眼睛应观察B;
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是待测溶液润洗锥形瓶,由此造成的测定结果偏高 (填偏高、偏低或无影响);
(4)步骤②缺少的操作是用标准液润洗滴定管;
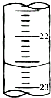
(5)如图,是某次滴定时的滴定管中的液面,其读数为22.60mL;
(6)根据如表数据:
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
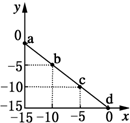 某温度下的溶液中c(H+)=10xmol/L,c(OH-)=10ymol/L.x与y的关系如图所示:下列说法正确的是( )
某温度下的溶液中c(H+)=10xmol/L,c(OH-)=10ymol/L.x与y的关系如图所示:下列说法正确的是( )| A. | 该温度高于25℃ | |
| B. | 图中a点溶液呈碱性 | |
| C. | 该温度下,0.01 mol•L-1的HCl溶液中,由水电离出的H+浓度为10-12 mol•L-1 | |
| D. | 该温度下,等体积浓度均为0.01 mol•L-1的HCl溶液与NaOH溶液恰好完全反应的pH=7 |
①用蒸馏水洗涤碱式滴定管,注入0.2000mol•L-1的标准NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数.
⑥重以上滴定操作2-3次.
请回答:
(1)以上步骤有错误的是(填编号)①,该错误操作会导致测定结果偏大 (填“偏大”、“偏小”或“无影响”).
(2)步骤④中,量取20.00mL待测液应使用酸式滴定管(填仪器名称),在锥形瓶装液前,留有少量蒸馏水,测定结果无影响(填“大”、“偏小”或“无影响”).
(3)步骤⑤滴定时眼睛应注视锥形瓶中溶液颜色变化;判断到达滴定终点的依据是:锥形瓶中溶液由无色变为浅红色,半分钟不变色.
(4)以下是实验数据记录表
| 滴定次数 | 盐酸体积(mL) | NaOH溶液体积读数(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.00 | 18.10 |
| 2 | 20.00 | 0.00 | 16.30 |
| 3 | 20.00 | 0.00 | 16.22 |
A.滴定前滴定管尖嘴有气泡,滴定结束无气泡
B.锥形瓶用待测液润洗
C.NaOH标准液保存时间过长,有部分变质
D.滴定结束时,俯视读数
(5)根据上表记录数据,通过计算可得,该盐酸浓度为:0.1626mol•L-1.
| A. | 第二周期元素从左到右,最高正价从+1递增到+7 | |
| B. | 同主族元素的简单阴离子还原性越强,其原子的非金属性越强 | |
| C. | IA族与 VIIA族元素间可形成共价化合物或离子化合物 | |
| D. | 同周期金属元素的化合价越高,其原子失电子能力越强 |
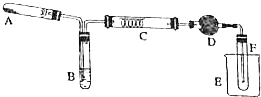 某化学兴趣小组对实验室乙醇催化氧化实验装置进行了改进,如图:试管A内为高锰酸钾固体,试管B内为无水乙醇,硬质试管C内为绕成螺旋状的细钢丝,干燥管D内为无水硫酸铜粉末.(图中加热仪器、夹持装置等都已略去)
某化学兴趣小组对实验室乙醇催化氧化实验装置进行了改进,如图:试管A内为高锰酸钾固体,试管B内为无水乙醇,硬质试管C内为绕成螺旋状的细钢丝,干燥管D内为无水硫酸铜粉末.(图中加热仪器、夹持装置等都已略去) A、B、C、D、E五种溶液分别是NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:
A、B、C、D、E五种溶液分别是NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验: