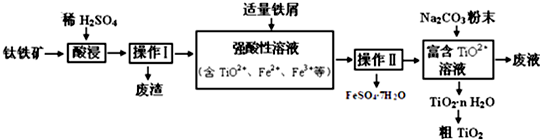
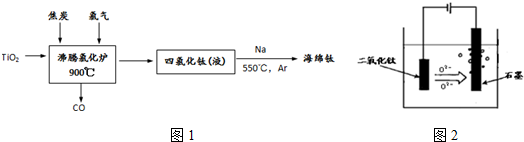
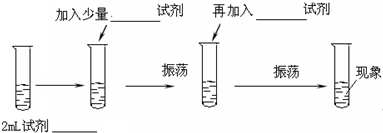
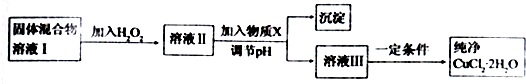
题目内容
11.下列有关元素的性质及其递变规律正确的是( )| A. | 第二周期元素从左到右,最高正价从+1递增到+7 | |
| B. | 同主族元素的简单阴离子还原性越强,其原子的非金属性越强 | |
| C. | IA族与 VIIA族元素间可形成共价化合物或离子化合物 | |
| D. | 同周期金属元素的化合价越高,其原子失电子能力越强 |
分析 A.第二周期,F、O无正价;
B.同主族元素的简单阴离子还原性越强,对应原子的非金属性越弱;
C.IA族含H及碱金属元素;
D.同周期金属元素的化合价越高,金属性越弱.
解答 解:A.第二周期,F、O无正价,则不能出现最高正价从+1递增到+7,故A错误;
B.同主族元素的简单阴离子还原性越强,对应原子的非金属性越弱,如卤素中I-还原性最强,I的非金属性最弱,故B错误;
C.IA族含H及碱金属元素,H与VIIA族元素间可形成共价化合物,碱金属与VIIA族元素间可形成离子化合物,故C正确;
D.同周期金属元素的化合价越高,金属性越弱,失去电子能力越弱,故D错误;
故选C.
点评 本题考查周期表的结构与应用,为高频考点,把握元素的位置、元素的性质、元素周期律为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
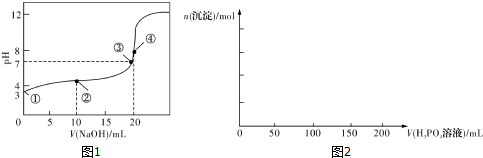
1.(1)常温下,用0.1000mol•L-1NaOH溶液滴定20.00mL0.100 0mol•L-1CH3COOH溶液所得滴定曲线如图1.已知起始①点溶液的pH为3,③点溶液的pH为7,则Ka(CH3COOH)=10-5.
(2)在用Na2SO3溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
0.01mol•L-1Na2SO3溶液中通人SO2至溶液呈中性时,溶液中的所有离子的浓度由大到小的顺序是c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-).
(3)向0.1mol•L-1的NaHSO3中通人氨气至溶液呈中性时,溶液中的c(H+)、c(OH-)、c(SO32-)、c(Na+)、c(NH4+)这五种离子浓度大小关系是c(Na+)>c(SO32-)>c(NH4+)>c(H+)=c(OH-).
(4)已知Ca3(PO4)2、CaHPO4均难溶于水,而Ca(H2PO4)2易溶,在含0.1molCa(OH)2的澄清石灰水中逐滴加人1mol•L-1的H3PO4:请在图2中作出生成沉淀的物质的量随H3PO4滴人体积从0开始至200mL的图象.

(2)在用Na2SO3溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 1:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
(3)向0.1mol•L-1的NaHSO3中通人氨气至溶液呈中性时,溶液中的c(H+)、c(OH-)、c(SO32-)、c(Na+)、c(NH4+)这五种离子浓度大小关系是c(Na+)>c(SO32-)>c(NH4+)>c(H+)=c(OH-).
(4)已知Ca3(PO4)2、CaHPO4均难溶于水,而Ca(H2PO4)2易溶,在含0.1molCa(OH)2的澄清石灰水中逐滴加人1mol•L-1的H3PO4:请在图2中作出生成沉淀的物质的量随H3PO4滴人体积从0开始至200mL的图象.
2.用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 一定条件下,将1 mol N2和3 mol H2混合,充分反应后转移的电子数为6 NA | |
| B. | 1.5 mol NO2与足量水反应,转移的电子数为1.5 NA | |
| C. | 6.4 g由S2、S4、S8组成的混合物含硫原子数为0.2 NA | |
| D. | 常温常压下,11.2 L Cl2含氯原子数为NA |
16.下列叙述中,正确的是( )
| A. | 第三周期元素的离子半径从左到右逐渐减小 | |
| B. | ⅥA族元素的原子,其半径越大,越容易得到电子 | |
| C. | ⅥA族元素的氢化物中,稳定性最好的其还原性最强 | |
| D. | IA族与 VIIA族元素间可形成共价化合物或离子化合物 |
20.将一定质量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中不正确的是( )
| A. | 溶解合金时收集到NO气体体积为2.24L(在标准状况) | |
| B. | 加入合金的质量不可能为9.6g | |
| C. | 沉淀完全时消耗NaOH溶液的体积为150mL | |
| D. | 参加反应的硝酸的物质的量为0.4mol |