题目内容
6.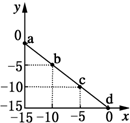 某温度下的溶液中c(H+)=10xmol/L,c(OH-)=10ymol/L.x与y的关系如图所示:下列说法正确的是( )
某温度下的溶液中c(H+)=10xmol/L,c(OH-)=10ymol/L.x与y的关系如图所示:下列说法正确的是( )| A. | 该温度高于25℃ | |
| B. | 图中a点溶液呈碱性 | |
| C. | 该温度下,0.01 mol•L-1的HCl溶液中,由水电离出的H+浓度为10-12 mol•L-1 | |
| D. | 该温度下,等体积浓度均为0.01 mol•L-1的HCl溶液与NaOH溶液恰好完全反应的pH=7 |
分析 A.温度越高水的电离程度越大,水的离子积增大,由Kw=c(H+).c(OH-)计算判断;
B.图中a点溶液c(OH-)=1mol/L,c(H+)=10-15,则c(OH-)>c(H+);
C.水电离出的H+浓度等于溶液中氢氧根离子浓度,根据Kw=c(H+).c(OH-)计算;
D.由图可知Kw=10-15,溶液呈中性时pH=7.5.
解答 解:A.根据图知,当c(H+)=10-5 mol/L,c(OH-)=10-10 mol/L,由离子积常数=c(H+).c(OH-)=10-5.10-10=10-15<10-14,所以该温度低于25℃,故A错误;
B.图中a点溶液c(OH-)=1mol/L,c(H+)=10-15,c(OH-)>c(H+),溶液呈碱性,故B正确;
C.水电离出的H+浓度等于溶液中氢氧根离子浓度,该温度下Kw=10-15,则水电离出的H+浓度为c(H+)=$\frac{1{0}^{-15}}{1{0}^{-2}}$mol/L=10-13mol/L,故C错误;
D.该温度下Kw=10-15,溶液呈中性时c(OH-)=c(H+),则溶液中c(H+)=10-7.5,则中性时溶液pH=7.5,故D错误.
故选B.
点评 本题考查溶液pH的有关计算、水的离子积,注意对水的离子积的理解,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.下列化学反应不能设计成实用电池是( )
| A. | Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O | B. | 2NaOH+CuSO4═Na2SO4+Cu(OH)2↓ | ||
| C. | 2CO+O2═2CO2 | D. | 2Al+2NaOH+2H2O═2NaAlO2+3H2↑ |
14.如图是侯氏制碱法在实验室进行模拟实验的生产流程示意图,则下列叙述正确的是( )


| A. | 第Ⅱ步的离子方程式为Na++NH3+H2O+CO2→NaHCO3↓+NH4+ | |
| B. | 第Ⅲ步得到的晶体是Na2CO3•10H2O | |
| C. | A气体是CO2,B气体是NH3 | |
| D. | 第Ⅳ步操作的过程主要有溶解、蒸发、结晶 |
1.(1)常温下,用0.1000mol•L-1NaOH溶液滴定20.00mL0.100 0mol•L-1CH3COOH溶液所得滴定曲线如图1.已知起始①点溶液的pH为3,③点溶液的pH为7,则Ka(CH3COOH)=10-5.
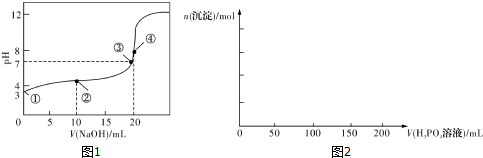
(2)在用Na2SO3溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
0.01mol•L-1Na2SO3溶液中通人SO2至溶液呈中性时,溶液中的所有离子的浓度由大到小的顺序是c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-).
(3)向0.1mol•L-1的NaHSO3中通人氨气至溶液呈中性时,溶液中的c(H+)、c(OH-)、c(SO32-)、c(Na+)、c(NH4+)这五种离子浓度大小关系是c(Na+)>c(SO32-)>c(NH4+)>c(H+)=c(OH-).
(4)已知Ca3(PO4)2、CaHPO4均难溶于水,而Ca(H2PO4)2易溶,在含0.1molCa(OH)2的澄清石灰水中逐滴加人1mol•L-1的H3PO4:请在图2中作出生成沉淀的物质的量随H3PO4滴人体积从0开始至200mL的图象.

(2)在用Na2SO3溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 1:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
(3)向0.1mol•L-1的NaHSO3中通人氨气至溶液呈中性时,溶液中的c(H+)、c(OH-)、c(SO32-)、c(Na+)、c(NH4+)这五种离子浓度大小关系是c(Na+)>c(SO32-)>c(NH4+)>c(H+)=c(OH-).
(4)已知Ca3(PO4)2、CaHPO4均难溶于水,而Ca(H2PO4)2易溶,在含0.1molCa(OH)2的澄清石灰水中逐滴加人1mol•L-1的H3PO4:请在图2中作出生成沉淀的物质的量随H3PO4滴人体积从0开始至200mL的图象.
18.滴定法是化学上常用的定量分析的方法.滴定的方法有酸碱中和滴定、氧化还原滴定、沉淀滴定、络合滴定等.
Ⅰ.甲化学兴趣小组取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用0.2000mol•L-1的标准NaOH溶液进行滴定.重复上述滴定操作3次,并记录数据.
(1)滴定时边滴边摇动锥形瓶,眼睛应观察B.(填序号)
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(2)判断滴定终点的现象是:溶液从无色变为浅红色,且半分钟内不变色.
(3)根据下列数据:请计算待测盐酸溶液的浓度为0.2000mol/L.
Ⅱ.乙化学兴趣小组利用氧化还原反应滴定,测定了某工厂废水中游离态氯的含量.实验如下:
①取水样10.0ml于锥形瓶中,加入10.0ml的KI溶液(足量),滴入指示剂2~3滴.
②将自己配制的0.01mol•L-1标准Na2S2O3溶液装入滴定管中,调整液面,记下读数.
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3=2NaI+2Na2S4O6.试回答下列问答:
(1)步骤①发生的化学反应方程式为:Cl2+KI=I2+2KCl;加入的指示剂是淀粉溶液.
(2)步骤②应使用碱式滴定管.
(3)氯的所测浓度比实际浓度会偏大,造成误差的原因可能是ACE(填序号)
A 配制标准Na2S2O3溶液定容时,加水超过刻度线
B 锥形瓶水洗后直接装待测水样
C 装标准Na2S2O3溶液的滴定管水洗后没有润洗
D 滴定到达终点时,俯视读出滴定管读数;
E 滴定前尖嘴部分有气泡,滴定后消失
Ⅲ.沉淀滴定所用的指示剂本身就是一种沉淀剂.已知一些银盐的颜色和Ksp(20℃)如下表,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定.
(1)滴定时,你认为该滴定适宜选用的指示剂是下列中的D.(填序号)
A.KBrB.KIC.K2S D.K2CrO4
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,$\frac{c(Br-)}{c(Cl-)}$=2.7×10-3.
Ⅰ.甲化学兴趣小组取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用0.2000mol•L-1的标准NaOH溶液进行滴定.重复上述滴定操作3次,并记录数据.
(1)滴定时边滴边摇动锥形瓶,眼睛应观察B.(填序号)
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(2)判断滴定终点的现象是:溶液从无色变为浅红色,且半分钟内不变色.
(3)根据下列数据:请计算待测盐酸溶液的浓度为0.2000mol/L.
| 滴定次数 | 待测液体积(mL) | 标准NaOH溶液读数记录(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 4.00 | 24.00 |
| 第三次 | 20.00 | 2.00 | 24.10 |
①取水样10.0ml于锥形瓶中,加入10.0ml的KI溶液(足量),滴入指示剂2~3滴.
②将自己配制的0.01mol•L-1标准Na2S2O3溶液装入滴定管中,调整液面,记下读数.
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3=2NaI+2Na2S4O6.试回答下列问答:
(1)步骤①发生的化学反应方程式为:Cl2+KI=I2+2KCl;加入的指示剂是淀粉溶液.
(2)步骤②应使用碱式滴定管.
(3)氯的所测浓度比实际浓度会偏大,造成误差的原因可能是ACE(填序号)
A 配制标准Na2S2O3溶液定容时,加水超过刻度线
B 锥形瓶水洗后直接装待测水样
C 装标准Na2S2O3溶液的滴定管水洗后没有润洗
D 滴定到达终点时,俯视读出滴定管读数;
E 滴定前尖嘴部分有气泡,滴定后消失
Ⅲ.沉淀滴定所用的指示剂本身就是一种沉淀剂.已知一些银盐的颜色和Ksp(20℃)如下表,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定.
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
| Ksp | 2.0×10-10 | 5.4×10-13 | 8.3×10-17 | 2.0×10-48 | 2.0×10-12 |
A.KBrB.KIC.K2S D.K2CrO4
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,$\frac{c(Br-)}{c(Cl-)}$=2.7×10-3.
15. 酸碱中和滴定是中学化学中重要的定量实验之一.某研究性学习小组准确进行了如下实验,称取1.00g不纯的苛性钠样品配成250ml溶液,取出10.00ml,用已知浓度为0.040mol•L-1的盐酸进行滴定(杂质不与盐酸反应).
酸碱中和滴定是中学化学中重要的定量实验之一.某研究性学习小组准确进行了如下实验,称取1.00g不纯的苛性钠样品配成250ml溶液,取出10.00ml,用已知浓度为0.040mol•L-1的盐酸进行滴定(杂质不与盐酸反应).
根据要求回答下列问题:
(1)配制250mL 0.040mol•L-1的盐酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和250mL容量瓶.
(2)为测定该苛性钠样品的纯度,几次滴定消耗盐酸的体积如下:
该苛性钠样品的纯度=80%.
(3)若操作过程中未用盐酸润洗滴定管,则测定结果将偏大(填“偏大”、“偏小”或“无影响”).
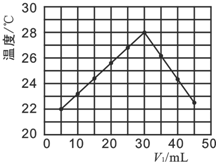
(4)在另一次实验中,研究性小组将V1 mL 1.0mol•L-1 HCl溶液和V2 mL 未知浓度的NaOH溶液均匀混合后,测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).
下列叙述中正确的是b.
a、该实验的环境温度为22℃
b、当V1=40时,溶液中c(Na+)<c(Cl-)
c、NaOH溶液的浓度为1.0mol•L-1
d、保持其他条件不变,只将HCl改为CH3COOH进行实验,也得到如图的实验结果.
 酸碱中和滴定是中学化学中重要的定量实验之一.某研究性学习小组准确进行了如下实验,称取1.00g不纯的苛性钠样品配成250ml溶液,取出10.00ml,用已知浓度为0.040mol•L-1的盐酸进行滴定(杂质不与盐酸反应).
酸碱中和滴定是中学化学中重要的定量实验之一.某研究性学习小组准确进行了如下实验,称取1.00g不纯的苛性钠样品配成250ml溶液,取出10.00ml,用已知浓度为0.040mol•L-1的盐酸进行滴定(杂质不与盐酸反应).根据要求回答下列问题:
(1)配制250mL 0.040mol•L-1的盐酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和250mL容量瓶.
(2)为测定该苛性钠样品的纯度,几次滴定消耗盐酸的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗盐酸溶液的体积(mL) | 20.05 | 20.00 | 22.10 | 19.95 |
(3)若操作过程中未用盐酸润洗滴定管,则测定结果将偏大(填“偏大”、“偏小”或“无影响”).
(4)在另一次实验中,研究性小组将V1 mL 1.0mol•L-1 HCl溶液和V2 mL 未知浓度的NaOH溶液均匀混合后,测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).
下列叙述中正确的是b.
a、该实验的环境温度为22℃
b、当V1=40时,溶液中c(Na+)<c(Cl-)
c、NaOH溶液的浓度为1.0mol•L-1
d、保持其他条件不变,只将HCl改为CH3COOH进行实验,也得到如图的实验结果.
16.下列叙述中,正确的是( )
| A. | 第三周期元素的离子半径从左到右逐渐减小 | |
| B. | ⅥA族元素的原子,其半径越大,越容易得到电子 | |
| C. | ⅥA族元素的氢化物中,稳定性最好的其还原性最强 | |
| D. | IA族与 VIIA族元素间可形成共价化合物或离子化合物 |
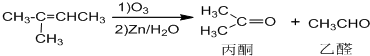
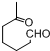 +NaOH+2Cu(OH)2$\stackrel{加热}{→}$
+NaOH+2Cu(OH)2$\stackrel{加热}{→}$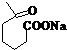 +Cu2O↓+3H2O.
+Cu2O↓+3H2O.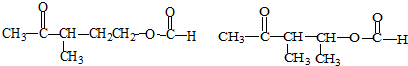
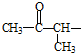 ②属于酯类 ③能发生银镜反应
②属于酯类 ③能发生银镜反应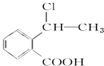 为原料制备
为原料制备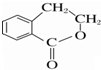 的合成路线流程图(无机试剂任用),并注明反应条件.
的合成路线流程图(无机试剂任用),并注明反应条件.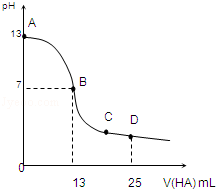 常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:
常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题: