题目内容
3.天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述正确的是( )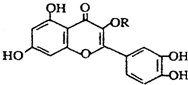
| A. | 若R为甲基则该物质的分子式可以表示为C16H10O7 | |
| B. | 分子中有三个苯环 | |
| C. | lmol该化合物与NaOH溶液作用消耗NaOH的物质的量以及与氢气加成所需的氢气的物质的量分别是4 mol、8 mol | |
| D. | lmol该化合物最多可与7molBr2完全反应 |
分析 由结构可知分子式,分子中含酚-OH、碳碳双键、羰基、醚键,结合酚、烯烃等有机物的性质来解答.
解答 解:A.若R为甲基则该物质的分子式可以表示为C16H12O7,故A错误;
B.只有2个苯环,故B错误;
C.只有酚-OH与NaOH反应,苯环与碳碳双键与氢气发生加成反应,则lmol该化合物与NaOH溶液作用消耗NaOH的物质的量以及与氢气加成所需的氢气的物质的量分别是4 mol、8 mol,故C正确;
D.酚-OH的邻对位与溴发生取代反应,碳碳双键与溴水发生加成反应,则lmol该化合物最多可与6molBr2完全反应,故D错误;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意烯烃及苯酚的性质,题目难度不大.

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案
相关题目
13.工业上电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法正确的是( )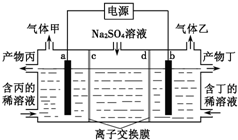

| A. | a极与电源的负极相连 | |
| B. | 产物丙为硫酸溶液 | |
| C. | 离子交换膜d为阴离子交换膜 | |
| D. | 每转移0.1mol e-则产生1.12L气体乙 |
14.化学在生产和日常生活中有着重要的应用,下列说法不正确的是( )
| A. | 钠的金属活动性排在铜前面,所以金属钠可以置换出硫酸铜溶液中的铜 | |
| B. | 铁制容器盛放和运输浓硫酸 | |
| C. | 明矾溶于水形成的Al(OH)3胶体能吸附水中悬浮物.可用于水的净化 | |
| D. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 |
18.能正确表示下列反应的离子方程式为( )
| A. | 硫化亚铁溶于稀硝酸中:FeS+2H+═Fe2++H2S↑ | |
| B. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| C. | 用催化法处理汽车尾气中的CO和NO:CO+NO$\stackrel{催化剂}{→}$C+NO2 | |
| D. | 大理石溶于醋酸中:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O |
15. 电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如下表所示:
电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如下表所示:
(1)已知25℃时,①HF(aq)+OH-(aq)═F-(aq)+H2O(l)△H=-67.7 kJ/mol,
②H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,
氢氟酸的电离方程式及热效应可表示为HF(aq)?H+(aq)+F-(aq)△H=-10.4kJ•mol-1.
(2)将浓度为0.1 mol/L HF溶液加水稀释一倍(假设温度不变),下列各量增大的是CD.
A.c(H+) B.c(H+)•c(OH-)
C.$\frac{c({H}^{+})}{c({H}^{-})}$ D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
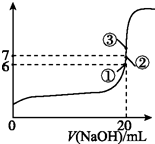
(3)在20 mL 0.1 mol/L氢氟酸中加入V mL 0.1 mol/L NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是BC.
A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中,c(F-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20 mL,此时溶液中c(F-)<c(Na+)=0.1 mol/L
(4)物质的量浓度均为0.1 mol/L的下列四种溶液:①Na2CO3溶液 ②NaHCO3溶液 ③NaF溶液④NaClO溶液.依据数据判断pH由大到小的顺序是①>④>②>③.
(5)Na2CO3溶液显碱性是因为CO${\;}_{3}^{2-}$水解的缘故,请设计简单的实验事实证明之在碳酸钠溶液中滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去或变浅.
(6)长期以来,一直认为氟的含氧酸不存在.1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H-O-F.HFO与水反应得到HF和化合物A,每生成1 mol HF转移1mol电子.
 电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如下表所示:
电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如下表所示:| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数(Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
②H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,
氢氟酸的电离方程式及热效应可表示为HF(aq)?H+(aq)+F-(aq)△H=-10.4kJ•mol-1.
(2)将浓度为0.1 mol/L HF溶液加水稀释一倍(假设温度不变),下列各量增大的是CD.
A.c(H+) B.c(H+)•c(OH-)
C.$\frac{c({H}^{+})}{c({H}^{-})}$ D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
(3)在20 mL 0.1 mol/L氢氟酸中加入V mL 0.1 mol/L NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是BC.
A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中,c(F-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20 mL,此时溶液中c(F-)<c(Na+)=0.1 mol/L
(4)物质的量浓度均为0.1 mol/L的下列四种溶液:①Na2CO3溶液 ②NaHCO3溶液 ③NaF溶液④NaClO溶液.依据数据判断pH由大到小的顺序是①>④>②>③.
(5)Na2CO3溶液显碱性是因为CO${\;}_{3}^{2-}$水解的缘故,请设计简单的实验事实证明之在碳酸钠溶液中滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去或变浅.
(6)长期以来,一直认为氟的含氧酸不存在.1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H-O-F.HFO与水反应得到HF和化合物A,每生成1 mol HF转移1mol电子.
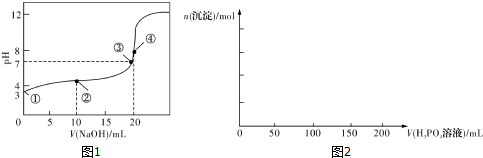
1.(1)常温下,用0.1000mol•L-1NaOH溶液滴定20.00mL0.100 0mol•L-1CH3COOH溶液所得滴定曲线如图1.已知起始①点溶液的pH为3,③点溶液的pH为7,则Ka(CH3COOH)=10-5.
(2)在用Na2SO3溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
0.01mol•L-1Na2SO3溶液中通人SO2至溶液呈中性时,溶液中的所有离子的浓度由大到小的顺序是c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-).
(3)向0.1mol•L-1的NaHSO3中通人氨气至溶液呈中性时,溶液中的c(H+)、c(OH-)、c(SO32-)、c(Na+)、c(NH4+)这五种离子浓度大小关系是c(Na+)>c(SO32-)>c(NH4+)>c(H+)=c(OH-).
(4)已知Ca3(PO4)2、CaHPO4均难溶于水,而Ca(H2PO4)2易溶,在含0.1molCa(OH)2的澄清石灰水中逐滴加人1mol•L-1的H3PO4:请在图2中作出生成沉淀的物质的量随H3PO4滴人体积从0开始至200mL的图象.

(2)在用Na2SO3溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 1:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
(3)向0.1mol•L-1的NaHSO3中通人氨气至溶液呈中性时,溶液中的c(H+)、c(OH-)、c(SO32-)、c(Na+)、c(NH4+)这五种离子浓度大小关系是c(Na+)>c(SO32-)>c(NH4+)>c(H+)=c(OH-).
(4)已知Ca3(PO4)2、CaHPO4均难溶于水,而Ca(H2PO4)2易溶,在含0.1molCa(OH)2的澄清石灰水中逐滴加人1mol•L-1的H3PO4:请在图2中作出生成沉淀的物质的量随H3PO4滴人体积从0开始至200mL的图象.
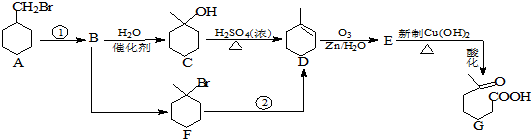
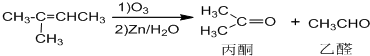
 +NaOH+2Cu(OH)2$\stackrel{加热}{→}$
+NaOH+2Cu(OH)2$\stackrel{加热}{→}$ +Cu2O↓+3H2O.
+Cu2O↓+3H2O.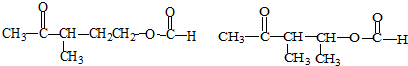
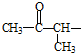 ②属于酯类 ③能发生银镜反应
②属于酯类 ③能发生银镜反应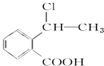 为原料制备
为原料制备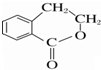 的合成路线流程图(无机试剂任用),并注明反应条件.
的合成路线流程图(无机试剂任用),并注明反应条件.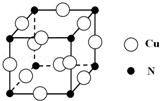 硼和氮元素在化学中有很重要的地位,回答下列问题:
硼和氮元素在化学中有很重要的地位,回答下列问题: .预计于2017年发射的“嫦娥五号”探测器采用的长征5号运载火箭燃料为偏二甲肼[(CH3)2NNH2].(CH3)2NNH2中N原子的杂化方式为sp3.
.预计于2017年发射的“嫦娥五号”探测器采用的长征5号运载火箭燃料为偏二甲肼[(CH3)2NNH2].(CH3)2NNH2中N原子的杂化方式为sp3.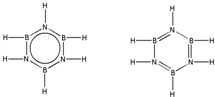 .
.