题目内容
20.在一定条件下,使CO和O2的混合气体30g充分反应,所得混合物在常温下跟足量的Na2O2固体反应,结果固体增重14g,则原混合气体中O2和CO的物质的量之比为( )| A. | 1:1 | B. | 7:8 | C. | 8:7 | D. | 5:4 |
分析 首先发生2CO+O2=2CO2,根据2Na2O2+2CO2=2Na2CO3+O2,可知混合物在常温下跟足量的Na2O2固体反应生成固体为Na2CO3,1molNa2O2生成1molNa2CO3,质量增加14g,恰好为CO的质量,以此判断原混合物中气体的质量之比.
解答 解:CO和O2的混合发生2CO+O2=2CO2,
由反应2Na2O2+2CO2=2Na2CO3+O2,可知混合物在常温下跟足量的Na2O2固体反应生成固体为Na2CO3,
1molNa2O2生成1molNa2CO3,质量增加14g,恰好为CO的质量,
固体增重14g,说明混合气体中CO为14g,则O2为30g-14g=16g,
则原混合气体中CO和O2的物质的量之比=$\frac{16g}{32g/mol}$:$\frac{14g}{28g/mol}$=1:1,
故选A.
点评 本题考查混合物反应的计算,题目难度增大,明确CO和O2的混合气体与过氧化钠反应使固体增加的质量为CO的质量为解答关键,注意掌握物质的量与摩尔质量之间的关系,试题培养了学生的化学计算能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.下列说法正确的是( )
| A. | 2 mol•L-1 KCl溶液与1 mol•L-1 K2SO4溶液等体积混合后,c(K+)为2 mol•L-1 | |
| B. | 120 g NaCl溶液中溶有20 g NaCl,该温度下NaCl的溶解度为20 g | |
| C. | 22.4 L HCl气体溶于水制成1 L溶液,该溶液的物质的量浓度为1 mol•L-1 | |
| D. | 把5 g胆矾溶于45 g水中,所得溶液溶质的质量分数为10% |
15.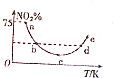 取5等份(各1mol)NO2,分别加入温度不同的2L恒容密闭容器中,发生反应:2NO2(g)?N2O4(g)△H<0.反应10s时,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图,据图分析,下列说法正确的是( )
取5等份(各1mol)NO2,分别加入温度不同的2L恒容密闭容器中,发生反应:2NO2(g)?N2O4(g)△H<0.反应10s时,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图,据图分析,下列说法正确的是( )
 取5等份(各1mol)NO2,分别加入温度不同的2L恒容密闭容器中,发生反应:2NO2(g)?N2O4(g)△H<0.反应10s时,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图,据图分析,下列说法正确的是( )
取5等份(各1mol)NO2,分别加入温度不同的2L恒容密闭容器中,发生反应:2NO2(g)?N2O4(g)△H<0.反应10s时,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图,据图分析,下列说法正确的是( )| A. | 10s内,图中a点对应的N2O4反应速率为0.01mol•L-1•s-1 | |
| B. | 图中b、d两点对应的NO2速率相等 | |
| C. | c点前后平衡移动的方向相反 | |
| D. | e点对应的容器中气体颜色最深 |
12.在一定温度下反应:2NO2(g)═N2O4(g)△H<0,其化学平衡常数为K,则下列说法正确的是( )
| A. | 相同温度,2N2O4(g)═4NO2(g)的反应热和化学平衡常数分别为-2△H和K2 | |
| B. | 该反应达到平衡后,缩小容器的容积,平衡右移,混合气体颜色变浅 | |
| C. | 若投入2mol NO2,通过控制外界条件,必能生成1mol N2O4 | |
| D. | 平衡时一定有v正(NO2)=2v逆(N2O4) |
9.现已发现的116号元素,已知它是氧族元素,则下列叙述错误的是( )
| A. | 不能形成稳定的气态氢化物 | B. | 其原子最外层有6个电子 | ||
| C. | 其最高价氧化物的水化物是强酸 | D. | X是金属元素 |
 氧化镁在医药、建筑等行业应用广泛,木炭还原硫酸镁煅烧制备高纯氧化镁是一种新的探索.煅烧过程存在以下反应:
氧化镁在医药、建筑等行业应用广泛,木炭还原硫酸镁煅烧制备高纯氧化镁是一种新的探索.煅烧过程存在以下反应: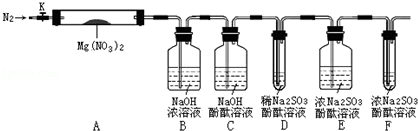
 ,步骤Ⅱ中,通入一段时间N2的目的是避免对分解产物O2的检验产生干扰.
,步骤Ⅱ中,通入一段时间N2的目的是避免对分解产物O2的检验产生干扰.