题目内容
9.现已发现的116号元素,已知它是氧族元素,则下列叙述错误的是( )| A. | 不能形成稳定的气态氢化物 | B. | 其原子最外层有6个电子 | ||
| C. | 其最高价氧化物的水化物是强酸 | D. | X是金属元素 |
分析 第七周期稀有气体的原子序数应为118,故116号元素处于第七周期ⅥA族,最外层电子数为6,最高正化合价为+6,金属性比Po强,属于金属元素,结合氧族元素及其化合物性质递变规律推测.
解答 解:第七周期稀有气体的原子序数应为118,故116号元素处于第七周期ⅥA族,最外层电子数为6,最高正化合价为+6,金属性比Po强,属于金属元素,
A.该元素为金属元素,其氢化物中表现正化合价,不能形成稳定的气态氢化物,故A正确;
B.116号元素处于第七周期ⅥA族,最外层电子数为6,故B正确;
C.同主族元素从上到下元素的非金属性逐渐减弱,金属性逐渐增强,其最高价氧化物的水化物应呈碱性,故C错误;
D.同主族元素从上到下元素的金属性逐渐增强,第六周期元素为Po,属于金属元素,则116号元素肯定为金属元素,故D正确,
故选C.
点评 本题考查原子结构与元素性质关系,难度不大,根据原子序数确定在周期表中的物质是关键,注意掌握同主族元素性质的相似性与递变性.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.如图所示的实验操作错误的是( )
| A. |  | B. |  | C. |  | D. |  |
20.在一定条件下,使CO和O2的混合气体30g充分反应,所得混合物在常温下跟足量的Na2O2固体反应,结果固体增重14g,则原混合气体中O2和CO的物质的量之比为( )
| A. | 1:1 | B. | 7:8 | C. | 8:7 | D. | 5:4 |
17.某兴趣小组对铜与浓硫酸反应产生的黑色沉淀(可能含有CuO、CuS、Cu2S,其中CuS和 Cu2S不溶于稀盐酸、稀硫酸)进行探究,实验步骤如下:
Ⅰ.将光亮铜丝插人浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
回答下列问题:
(1)步骤Ⅱ产生气体的化学式为SO2.
(2)向含微量 Cu2+试液中滴加K4[Fe(CN)6]溶液,能产生红褐色沉淀.现将少量黑色沉淀放入稀硫酸中,充分振荡以后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀,由此所得结论是黑色沉淀中不含有CuO.
(3)为证明黑色沉淀含有铜的硫化物,进行如下实验:
(4)CuS固体能溶于热的浓硫酸,请用有关平衡移动原理加以解释:CuS存在溶解平衡CuS(s) Cu2+(aq)+S2-(aq),热的浓硫酸将S2-氧化,使S2-浓度减小,促进上述平衡向正向移动,使CuS溶解.
(5)为测定黑色沉淀中Cu2S 的百分含量,取0.2g 步骤Ⅰ所得黑色沉淀,在酸性溶液中用 40.0mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+═10Cu2++5SO2↑+8Mn2++22H2O
6MnO4-+5CuS+28H+═5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,过量的高锰酸钾溶液恰好与35.0mL 0.1mol/L (NH4)2Fe(SO4)2 溶液反应完全.则混合物中Cu2S 的质量分数为40%.
Ⅰ.将光亮铜丝插人浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
回答下列问题:
(1)步骤Ⅱ产生气体的化学式为SO2.
(2)向含微量 Cu2+试液中滴加K4[Fe(CN)6]溶液,能产生红褐色沉淀.现将少量黑色沉淀放入稀硫酸中,充分振荡以后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀,由此所得结论是黑色沉淀中不含有CuO.
(3)为证明黑色沉淀含有铜的硫化物,进行如下实验:
| 装置 | 现象 | 结论及解释 |
 | ①A试管中黑色沉淀逐渐溶解 ②A试管上方出现红棕色气体 ③B试管中出现白色沉淀 | a.现象②说明褐色沉淀具有 还原性. b.试管B中产生白色沉淀的总反应的离子方程式为 NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+ |
(5)为测定黑色沉淀中Cu2S 的百分含量,取0.2g 步骤Ⅰ所得黑色沉淀,在酸性溶液中用 40.0mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+═10Cu2++5SO2↑+8Mn2++22H2O
6MnO4-+5CuS+28H+═5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,过量的高锰酸钾溶液恰好与35.0mL 0.1mol/L (NH4)2Fe(SO4)2 溶液反应完全.则混合物中Cu2S 的质量分数为40%.
14.在相同条件下能进行如下三个反应:
2A-+B2═2B-+A2
2C-+A2═2A-+C2
2B-+D2═2D-+B2
由此可判断以下分析正确的是( )
2A-+B2═2B-+A2
2C-+A2═2A-+C2
2B-+D2═2D-+B2
由此可判断以下分析正确的是( )
| A. | 氧化性:A2>B2>C2>D2 | B. | 还原性:C->A->B->D- | ||
| C. | 2A-+D2═2D-+A2的反应能进行 | D. | 2C-+B2═2B-+C2的反应不能进行 |
1.欲将蛋白质从水中析出而又不改变它的性质,应加入( )
| A. | 甲醛溶液 | B. | 饱和(NH4)2SO4溶液 | C. | 75%酒精 | D. | 硫酸铜溶液 |
19.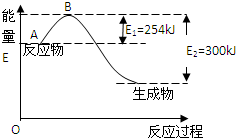 氮元素在地球上丰度较大,氮及其化合物用途广泛.请回答:
氮元素在地球上丰度较大,氮及其化合物用途广泛.请回答:
(1)如图是氮气和氢气反应生成1mol氨气的能量变化示意图,写出上述反应的热化学方程式:N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol
(2)已知下列数据:
根据表中和图中数据,计算N-H的键能为:390 kJ/mol
(3)用氨催化还原NOx(氮氧化物),可消除污染.
已知:4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H1=-a kJ/mol
N2(g)+O2(g)═2NO(g)△H2=-b kJ/mol
则反应:4NH3(g)+6NO(g)═5N2(g)+6H2O(g) 的反应热△H=-(a+3b)kJ/mol (用含a和b的代数式表示)其中氧化剂是NO,还原剂是NH3(均填分子式)
 氮元素在地球上丰度较大,氮及其化合物用途广泛.请回答:
氮元素在地球上丰度较大,氮及其化合物用途广泛.请回答:(1)如图是氮气和氢气反应生成1mol氨气的能量变化示意图,写出上述反应的热化学方程式:N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol
(2)已知下列数据:
| 化学键 | H-H | N≡N |
| 键能/( kJ/mol) | 435 | 943 |
(3)用氨催化还原NOx(氮氧化物),可消除污染.
已知:4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H1=-a kJ/mol
N2(g)+O2(g)═2NO(g)△H2=-b kJ/mol
则反应:4NH3(g)+6NO(g)═5N2(g)+6H2O(g) 的反应热△H=-(a+3b)kJ/mol (用含a和b的代数式表示)其中氧化剂是NO,还原剂是NH3(均填分子式)