��Ŀ����
10������Ҫ��д����Ӧ�Լ��ͷ���ʽ����1������KCl��Һ��K2CO3���Լ����Ȼ�����Һ�����ӷ���ʽΪ��Ca2++CO32-=CaCO3����
��2����ȥ����þ���е����۵��Լ�������������Һ�����ӷ���ʽΪ��2Al+2OH-+2H2O=2AlO2-+3H2����
��3���Ʊ�Ư�۵Ļ�ѧ����ʽΪ��2Cl2+2Ca��OH��2=CaCl2+Ca��ClO��2+2H2O��
��4���������ƿɺ�������е�����������ԭ���û�ѧ����ʽ���Ա�ʾΪ��2Na2O2+2CO2=2Na2CO3+O2��2Na2O2+2H2O=4NaOH+O2����
���� ��1��̼������Ȼ��Ʒ�Ӧ����̼��Ƴ������Ȼ������Ȼ��Ʋ���Ӧ��
��2������������Һ������Ӧ����ƫ�����ƺ�������þ������������Һ����Ӧ��
��3��������ʯ���鷴Ӧ�����Ȼ��ơ�������ƺ�ˮ��
��4���������ƺͶ�����̼��Ӧ����̼���ƺ���������ˮ��Ӧ�����������ƺ�������
��� �⣺��1��̼������Ȼ��Ʒ�Ӧ����̼��Ƴ������Ȼ������Ȼ��Ʋ���Ӧ���������Ȼ��Ƽ������ӷ���ʽ��Ca2++CO32-=CaCO3����
�ʴ�Ϊ���Ȼ�����Һ��Ca2++CO32-=CaCO3����
��2������������Һ������Ӧ����ƫ�����ƺ�������þ������������Һ����Ӧ������������������Һ��ȥ���ۣ����ӷ���ʽ��2Al+2OH-+2H2O=2AlO2-+3H2����
�ʴ�Ϊ������������Һ��2Al+2OH-+2H2O=2AlO2-+3H2����
��3����ҵ�Ʊ�Ư���������������������Ʒ�Ӧ�����Ȼ��ơ�������ƺ�ˮ����Ӧ�Ļ�ѧ����ʽΪ��2Cl2+2Ca��OH��2=CaCl2+Ca��ClO��2+2H2O��
�ʴ�Ϊ��2Cl2+2Ca��OH��2=CaCl2+Ca��ClO��2+2H2O��
��4���������ƺͶ�����̼��Ӧ����̼���ƺ���������ˮ��Ӧ�����������ƺ����������ݷ�Ӧ�����������д����ʽΪ2Na2O2+2CO2=2Na2CO3+O2��2Na2O2+2H2O=4NaOH+O2����
�ʴ�Ϊ��2Na2O2+2CO2=2Na2CO3+O2��2Na2O2+2H2O=4NaOH+O2����
���� ���⿼�������ʵļ�������ӣ����ؿ��黯ѧ����ʽ�����ӷ���ʽ��д����ȷ��Ӧʵ���ǽ���ؼ���ע����дʱ��ѭ�����غ㡢����غ���ɣ���Ŀ�ѶȲ���

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�| A�� | 1��1 | B�� | 7��8 | C�� | 8��7 | D�� | 5��4 |
| A�� | ��ȩ��Һ | B�� | ���ͣ�NH4��2SO4��Һ | C�� | 75%�ƾ� | D�� | ����ͭ��Һ |
| A�� | �ռ���Һ | B�� | ������ | C�� | Ũ���� | D�� | ��̿ |
| A�� | ���Ȼ�۳� | B�� | ������������� | ||
| C�� | ��������������Ĥ | D�� | ��ɢ�ʿ�����С��1-100nm֮�� |
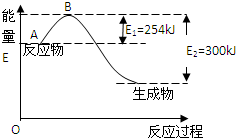 ��Ԫ���ڵ����Ϸ�Ƚϴ����仯������;�㷺����ش�
��Ԫ���ڵ����Ϸ�Ƚϴ����仯������;�㷺����ش���1����ͼ�ǵ�����������Ӧ����1mol�����������仯ʾ��ͼ��д��������Ӧ���Ȼ�ѧ����ʽ��N2��g��+3H2��g��?2NH3��g����H=-92kJ/mol
��2����֪�������ݣ�
| ��ѧ�� | H-H | N��N |
| ����/�� kJ/mol�� | 435 | 943 |
��3���ð�����ԭNOx�������������������Ⱦ��
��֪��4NH3��g��+3O2��g���T2N2��g��+6H2O��g����H1=-a kJ/mol
N2��g��+O2��g���T2NO��g����H2=-b kJ/mol
��Ӧ��4NH3��g��+6NO��g���T5N2��g��+6H2O��g�� �ķ�Ӧ�ȡ�H=-��a+3b��kJ/mol ���ú�a��b�Ĵ���ʽ��ʾ��������������NO����ԭ����NH3���������ʽ��
 ϼʯ��һ�ֹ����Σ�����ɿɱ�ʾΪK2O•3Na2O•4Al2O3•8SiO2��ijС��ͬѧ�����ϼʯΪԭ���Ʊ�Al2O3�ķ������£�
ϼʯ��һ�ֹ����Σ�����ɿɱ�ʾΪK2O•3Na2O•4Al2O3•8SiO2��ijС��ͬѧ�����ϼʯΪԭ���Ʊ�Al2O3�ķ������£�