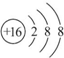
题目内容
11.下列说法正确的是( )| A. | 2 mol•L-1 KCl溶液与1 mol•L-1 K2SO4溶液等体积混合后,c(K+)为2 mol•L-1 | |
| B. | 120 g NaCl溶液中溶有20 g NaCl,该温度下NaCl的溶解度为20 g | |
| C. | 22.4 L HCl气体溶于水制成1 L溶液,该溶液的物质的量浓度为1 mol•L-1 | |
| D. | 把5 g胆矾溶于45 g水中,所得溶液溶质的质量分数为10% |
分析 A.KCl溶液与 K2SO4溶液中c(K+)均为2 mol•L-1,混合后溶液中钾离子浓度不变;
B.120 g NaCl溶液中溶有20 g NaCl,该溶液不一定为饱和溶液;
C.HCl不一定处于标况下,22.4LHCl的物质的量不一定为1mol;
D.根据胆矾化学式CuSO4.5H2O计算硫酸铜的质量,再根据质量分数=$\frac{溶质质量}{溶液质量}$×100%计算.
解答 解:A.KCl溶液与 K2SO4溶液中c(K+)均为2 mol•L-1,混合后溶液中钾离子浓度不变,即等体积混合后溶液中c(K+)为2 mol•L-1,故A正确;
B.120 g NaCl溶液中溶有20 g NaCl,该溶液不一定为饱和溶液,该温度下NaCl的溶解度不一定为20 g,故B错误;
C.体积一定时,温度、压强影响气体的物质的量,22.4LHCl的物质的量不一定为1mol,则溶于水制成1 L溶液,该溶液的物质的量浓度不一定为1 mol•L-1,故C错误;
D.5 g胆矾溶于水,溶液中硫酸铜的质量为5g×$\frac{160}{250}$=3.2g,溶液质量分数=$\frac{3.2g}{5g+45g}$×100%=6.4%,故D错误,
故选:A.
点评 本题考查物质的量有关计算、气体摩尔体积、溶解度、物质的量浓度等,注意对公式的理解与灵活应用,注意根据PV=nRT理解温度、压强对气体摩尔体积的影响.

练习册系列答案
相关题目
1.有关反应的离子方程式书写正确的是( )
| A. | a mol FeBr2溶液中通入a mol Cl2:2Fe2++2Br-+2Cl2═Br2+2Fe3++4Cl- | |
| B. | 向KI与稀硫酸的混合溶液中通入氧气:4H++O2+6I-═3I2+2H2O | |
| C. | 向50mL 1mol•L-1明矾溶液中滴入数滴0.1mol•L-1Ba(OH)2溶液:Al3++2SO42-+2Ba2++3OH-═Al(OH)3↓+2BaSO4↓ | |
| D. | 在澄清石灰水中加入少量碳酸氢镁溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O |
19.如图所示的实验操作错误的是( )
| A. |  | B. |  | C. |  | D. |  |
3.下列叙述正确的是( )
| A. | 合成氨工业中,移走NH3可增大正反应速率,提高原料转化率 | |
| B. | 酸碱中和滴定时,锥形瓶需用待测液润洗2~3次,再加入待测液 | |
| C. | 将NO2、N2O4混合气体的体积压缩为原来的一半,则气体颜色加深 | |
| D. | 电解精炼铜过程中,阳极质量的减少与阴极质量的增加一定相等 |
20.在一定条件下,使CO和O2的混合气体30g充分反应,所得混合物在常温下跟足量的Na2O2固体反应,结果固体增重14g,则原混合气体中O2和CO的物质的量之比为( )
| A. | 1:1 | B. | 7:8 | C. | 8:7 | D. | 5:4 |
1.欲将蛋白质从水中析出而又不改变它的性质,应加入( )
| A. | 甲醛溶液 | B. | 饱和(NH4)2SO4溶液 | C. | 75%酒精 | D. | 硫酸铜溶液 |