题目内容
5.为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如下图所示的实验装置.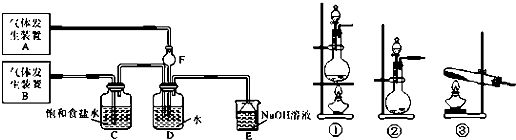
(1)该组同学为了制取Cl2,SO2气体,现采用Na2SO3与70%的浓硫酸为原料制取SO2,采用MnO2和浓盐酸(12mol/L)为原料制取Cl2.在此实验中,发生装置B应选择三种装置中的①(选填序号),F的作用是防止倒吸.
(2)D装置中主要反应的离子方程式为SO2+Cl2+2H2O=SO42-+2Cl-+4H+.
(3)为检验通入D装置中的Cl2是否过量,该组同学取适量D溶液滴加至盛有少量紫色石蕊的试管中,若出现石蕊(先变红后)褪色现象,则Cl2过量,此时E中发生的离子反应方程式为2OH-+Cl2=Cl-+ClO-+H2O,若D中出现石蕊变红实验现象,则氯气不过量.
分析 由装置可知,A中Na2SO3与70%的浓硫酸为原料制取SO2,B中MnO2和浓盐酸(12mol/L)为原料制取Cl2,C中饱和食盐水除去氯气中的HCl,D中发生SO2+Cl2+2H2O=SO2-4+2Cl-+4H+,E为尾气处理,制备氯气为固体、液体反应且加热装置,F中球形结构可防止倒吸,以此来解答.
解答 解:由装置可知,A中Na2SO3与70%的浓硫酸为原料制取SO2,B中MnO2和浓盐酸(12mol/L)为原料制取Cl2,C中饱和食盐水除去氯气中的HCl,D中发生SO2+Cl2+2H2O=SO42-+2Cl-+4H+,E为尾气处理,
(1)制备氯气为固体、液体反应且加热装置,发生装置B应选择三种装置中的①,F中球形结构可防止倒吸,则F的作用为防止倒吸,
故答案为:①;防止倒吸;
(2)D装置中主要反应的离子方程式为SO2+Cl2+2H2O=SO42-+2Cl-+4H+,故答案为:SO2+Cl2+2H2O=SO42-+2Cl-+4H+;
(3)二氧化硫为酸性氧化物,氯气可使石蕊褪色,则为检验通入D装置中的Cl2是否过量,该组同学取适量D溶液滴加至盛有少量紫色石蕊的试管中,若出现石蕊(先变红后)褪色现象,则Cl2过量,此时E中发生的离子反应方程式为2OH-+Cl2=Cl-+ClO-+H2O,若D中出现石蕊变红实验现象,则氯气不过量,
故答案为:石蕊(先变红后)褪色;2OH-+Cl2=Cl-+ClO-+H2O;石蕊变红.
点评 本题考查性质实验方案的设计,为高频考点,把握实验装置的作用、气体的制备实验、物质的性质及发生的反应为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目
15.在常温下,下列溶液中有关微粒浓度的关系正确的是( )
| A. | 0.1mol•L-1(NH4)2Fe(SO4)2溶液:c (SO42-)>c(NH4+)>c(Fe2+)>c(H+) | |
| B. | 0.1mol•L-1pH为4的NaHSO3溶液中:c(HSO3-)>c(H2SO3)>c(SO32-) | |
| C. | 0.1 mol•L-1 Na2S溶液中:2c(Na+)═c(S2-)+c(HS-)+c(H2S) | |
| D. | 某二元弱酸的酸式盐NaHA溶液:c(Na+)+c(H+)═c(OH-)+c(HA-)+c(A2-) |
13.下列各组中均为两瓶无标签的无色溶液,不许使用其它任何试剂(包括水),也能鉴别出来的是( )
①NaOH和Al2(SO4)3②Na2CO3和盐酸③NaHCO3和盐酸④盐酸和NaAlO2.
①NaOH和Al2(SO4)3②Na2CO3和盐酸③NaHCO3和盐酸④盐酸和NaAlO2.
| A. | ①②③ | B. | ②③④ | C. | ①③④ | D. | ①②④ |
20.在一定条件下,使CO和O2的混合气体30g充分反应,所得混合物在常温下跟足量的Na2O2固体反应,结果固体增重14g,则原混合气体中O2和CO的物质的量之比为( )
| A. | 1:1 | B. | 7:8 | C. | 8:7 | D. | 5:4 |
10.下列图示与对应的叙述相符的是( )
| A. | 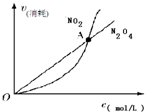 表示在恒容密闭容器中,恒温条件下发生的可逆反应2NO2(g)?N2O4(g),各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| B. | 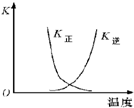 曲线表示反应2A(g)+B(g)?2C(g)△H>0,正、逆反应的平衡常数K随温度的变化 | |
| C. | 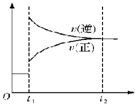 表示对反应2X(g)+Y(g)?Z(s)+3W(g)△H<0 在t1时刻增大压强 | |
| D. | 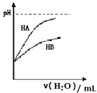 表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液pH |
17.某兴趣小组对铜与浓硫酸反应产生的黑色沉淀(可能含有CuO、CuS、Cu2S,其中CuS和 Cu2S不溶于稀盐酸、稀硫酸)进行探究,实验步骤如下:
Ⅰ.将光亮铜丝插人浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
回答下列问题:
(1)步骤Ⅱ产生气体的化学式为SO2.
(2)向含微量 Cu2+试液中滴加K4[Fe(CN)6]溶液,能产生红褐色沉淀.现将少量黑色沉淀放入稀硫酸中,充分振荡以后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀,由此所得结论是黑色沉淀中不含有CuO.
(3)为证明黑色沉淀含有铜的硫化物,进行如下实验:
(4)CuS固体能溶于热的浓硫酸,请用有关平衡移动原理加以解释:CuS存在溶解平衡CuS(s) Cu2+(aq)+S2-(aq),热的浓硫酸将S2-氧化,使S2-浓度减小,促进上述平衡向正向移动,使CuS溶解.
(5)为测定黑色沉淀中Cu2S 的百分含量,取0.2g 步骤Ⅰ所得黑色沉淀,在酸性溶液中用 40.0mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+═10Cu2++5SO2↑+8Mn2++22H2O
6MnO4-+5CuS+28H+═5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,过量的高锰酸钾溶液恰好与35.0mL 0.1mol/L (NH4)2Fe(SO4)2 溶液反应完全.则混合物中Cu2S 的质量分数为40%.
Ⅰ.将光亮铜丝插人浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
回答下列问题:
(1)步骤Ⅱ产生气体的化学式为SO2.
(2)向含微量 Cu2+试液中滴加K4[Fe(CN)6]溶液,能产生红褐色沉淀.现将少量黑色沉淀放入稀硫酸中,充分振荡以后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀,由此所得结论是黑色沉淀中不含有CuO.
(3)为证明黑色沉淀含有铜的硫化物,进行如下实验:
| 装置 | 现象 | 结论及解释 |
 | ①A试管中黑色沉淀逐渐溶解 ②A试管上方出现红棕色气体 ③B试管中出现白色沉淀 | a.现象②说明褐色沉淀具有 还原性. b.试管B中产生白色沉淀的总反应的离子方程式为 NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+ |
(5)为测定黑色沉淀中Cu2S 的百分含量,取0.2g 步骤Ⅰ所得黑色沉淀,在酸性溶液中用 40.0mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+═10Cu2++5SO2↑+8Mn2++22H2O
6MnO4-+5CuS+28H+═5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,过量的高锰酸钾溶液恰好与35.0mL 0.1mol/L (NH4)2Fe(SO4)2 溶液反应完全.则混合物中Cu2S 的质量分数为40%.
14.在相同条件下能进行如下三个反应:
2A-+B2═2B-+A2
2C-+A2═2A-+C2
2B-+D2═2D-+B2
由此可判断以下分析正确的是( )
2A-+B2═2B-+A2
2C-+A2═2A-+C2
2B-+D2═2D-+B2
由此可判断以下分析正确的是( )
| A. | 氧化性:A2>B2>C2>D2 | B. | 还原性:C->A->B->D- | ||
| C. | 2A-+D2═2D-+A2的反应能进行 | D. | 2C-+B2═2B-+C2的反应不能进行 |
15.不能与SiO2发生反应的物质是( )
| A. | 烧碱溶液 | B. | 氧化钙 | C. | 浓硝酸 | D. | 焦炭 |