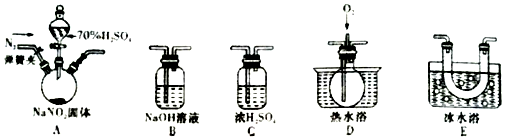
题目内容
11.短周期元素A、B、C、D、E、F的原子序数逐渐增大,A和B同周期,A和F同族,A原子最外层电子数是内层电子数的二倍,B元素族序数是周期数的三倍,B的简单阴离子与C、D、E的简单阳离子电子层结构相同.请回答下列有关问题:(1)F在元素周期表中的位置是第三周期第ⅣA族.
(2)C2B2的电子式是
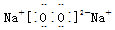 ;AB2的结构式是O=C=O.
;AB2的结构式是O=C=O.(3)B、C、D、E离子半径由大到小的顺序为O2->Na+>Mg2+>Al3+(用离子符号回答);
C、D、E最高价氧化物对应水化物的碱性由强到弱的顺序为NaOH>Mg(OH)2>Al(OH)3(用化学式表示,且用“>”符号连接回答).
(4)C、E最高价氧化物对应水化物能够相互反应,则反应的离子方程式为Al(OH)3+OH-=AlO2-+2 H2O.
分析 A、B、C、D、E、F的原子序数逐渐增大,A原子最外层电子数是内层电子数的二倍,则A为碳元素,A和F同族,则F为硅元素,A和B同周期,B元素族序数是周期数的三倍,则B为氧元素,B的阴离子与C、D、E的简单阳离子电子层结构相同,则C为钠元素,D是镁元素、E是铝,据此答题.
解答 解:(1)硅在元素周期表中的位置是第三周期第ⅣA族,故答案为:第三周期第ⅣA族;
(2)过氧化钠的电子式是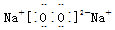 ;二氧化碳的结构式是O=C=O,故答案为:
;二氧化碳的结构式是O=C=O,故答案为: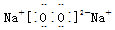 ; O=C=O;
; O=C=O;
(3)电子层数越多,离子半径越大,电子层数相同时,核电荷数越多,离子半径越小,所以B、C、D、E离子半径的由大到小的顺序为O2->Na+>Mg2+>Al3+,元素的金属性越强,对应的最高价氧化物对应水化物的碱性就越强,金属性Na>Mg>Al,所以碱性NaOH>Mg(OH)2>Al(OH)3,
故答案为:O2->Na+>Mg2+>Al3+; NaOH>Mg(OH)2>Al(OH)3;
(4)钠、铝最高价氧化物对应水化物能够相互反应,即氢氧化钠和氢氧化铝反应,其离子方程式为Al(OH)3+OH-=AlO2-+2 H2O,
故答案为:Al(OH)3+OH-=AlO2-+2 H2O.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重对基础知识的巩固,注意对基础知识的掌握.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
1.下列物质的分类合理的是( )
| A. | 酸性氧化物:CO2、SO2、H2O | B. | 碱性氧化物:Na2O、CaO、P2O5 | ||
| C. | 碱:NaOH、KOH、Ba(OH)2 | D. | 铵盐:NH4Cl、NH4NO3、(NH4)2SO4 |
2.短周期元素的性质或原子结构如表:
(1)写出元素X的离子结构示意图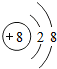 .写出元素Z的气态氢化物的电子式
.写出元素Z的气态氢化物的电子式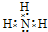 (用元素符号表示)
(用元素符号表示)
(2)写出Y元素最高价氧化物水化物的电离方程式H++AlO2-+H2O?Al(OH)3?Al3++3OH-.
(3)元素T与氯元素相比,非金属性较强的是F(用元素符号表示).
| 元素编号 | 元素性质或原子结构 |
| T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
| X | L层p电子数比s电子数多2个 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | L层有三个未成对电子 |
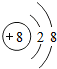 .写出元素Z的气态氢化物的电子式
.写出元素Z的气态氢化物的电子式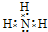 (用元素符号表示)
(用元素符号表示)(2)写出Y元素最高价氧化物水化物的电离方程式H++AlO2-+H2O?Al(OH)3?Al3++3OH-.
(3)元素T与氯元素相比,非金属性较强的是F(用元素符号表示).
19.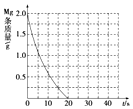 为了探究镁条与盐酸、醋酸反应时,浓度或温度对反应速率(观察镁条消失的时间)的影响,准备了以下化学用品:0.20mol•L-1与0.40mol•L-1的HCl溶液、0.20mol•L-1与0,.40mol•L-1的CH3COOH溶液、4条镁条(形状、大小、质量相同)、几支试管和胶头滴管,酸液温度控制为298K和308K.
为了探究镁条与盐酸、醋酸反应时,浓度或温度对反应速率(观察镁条消失的时间)的影响,准备了以下化学用品:0.20mol•L-1与0.40mol•L-1的HCl溶液、0.20mol•L-1与0,.40mol•L-1的CH3COOH溶液、4条镁条(形状、大小、质量相同)、几支试管和胶头滴管,酸液温度控制为298K和308K.
①酸液都取足量、相同体积,请你帮助完成以下实验设计表:
②若①中实验a镁条消失的时间是20s,则镁条剩余质量与时间关系图如图.
假设:该反应温度每升高10℃,反应速率是原来的2倍;温度相同时,醋酸是相同浓度盐酸平均速度的$\frac{1}{2}$,请在此图中大致画出“实验b”、“实验d”的镁条剩余质量与时间关系曲线,请注意必要的标注.
 为了探究镁条与盐酸、醋酸反应时,浓度或温度对反应速率(观察镁条消失的时间)的影响,准备了以下化学用品:0.20mol•L-1与0.40mol•L-1的HCl溶液、0.20mol•L-1与0,.40mol•L-1的CH3COOH溶液、4条镁条(形状、大小、质量相同)、几支试管和胶头滴管,酸液温度控制为298K和308K.
为了探究镁条与盐酸、醋酸反应时,浓度或温度对反应速率(观察镁条消失的时间)的影响,准备了以下化学用品:0.20mol•L-1与0.40mol•L-1的HCl溶液、0.20mol•L-1与0,.40mol•L-1的CH3COOH溶液、4条镁条(形状、大小、质量相同)、几支试管和胶头滴管,酸液温度控制为298K和308K.①酸液都取足量、相同体积,请你帮助完成以下实验设计表:
| 实验 编号 | 温度(K) | 盐酸浓度/ (mol•L-1) | 醋酸浓度/ (mol•L-1) | 实验目的 |
| a | 298 | 0.20 | I.实验a和b是探究温度 对镁与盐酸反应速率的影响; II.实验a和c是探究浓度 对镁与盐酸反应速率的影响; III.实验a和d是探究相同温度下,相同浓度的盐酸、醋酸与镁反应速率的区别 | |
| b | 308 | 0.20 | ||
| c | 298 | 0.40 | ||
| d | -- | -- |
假设:该反应温度每升高10℃,反应速率是原来的2倍;温度相同时,醋酸是相同浓度盐酸平均速度的$\frac{1}{2}$,请在此图中大致画出“实验b”、“实验d”的镁条剩余质量与时间关系曲线,请注意必要的标注.
16.有人设想合成具有以下结构的四种烃分子,下列有关说法错误的是( )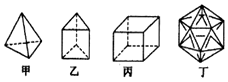

| A. | 1mol甲分子内含有10mol共价键 | B. | 乙分子的一氯取代产物只有一种 | ||
| C. | 丙分子的二氯取代产物只有两种 | D. | 丁分子显然是不可能合成的 |
3.反应2NO+2CO $\frac{\underline{\;催化剂\;}}{△}$ N2+2CO2是汽车尾气的净化原理.下列判断正确的是( )
| A. | 该反应是置换反应 | B. | 该反应是复分解反应 | ||
| C. | CO发生氧化反应 | D. | NO是还原剂 |
20.绿色化学提倡化工生产应提高原子利用率.原子利用率表示目标产物的质量与生成物总质量之比.在下列氮肥的制备反应中,原子利用率最高的是( )
| A. | NH3+H2O+CO2=NH4HCO3 | |
| B. | 2NH3+CO2$\frac{\underline{\;180-200℃\;}}{15-30MPa}$ CO(NH2)2+H2O | |
| C. | 8NH3+3Cl2═N2+6NH4Cl | |
| D. | 2NH3+2O2$\frac{\underline{\;一定条件\;}}{\;}$NH4NO3+H2O |
1.下列物质中,属于共价化合物的是( )
| A. | 氯化镁 | B. | 二氧化碳 | C. | 氢气 | D. | 硫酸铜 |