题目内容
1.将铜和镁组成的2.24g混合物投入适量某浓度的硝酸中完全反应,还原产物中有NO2、NO、N2O三种气体,且体积均为0.224L(标准状况),然后向反应后的溶液中,加入足量的NaOH溶液,所得沉淀经过滤、洗涤、干燥后称量,质量为( )| A. | 3.12g | B. | 4.28g | C. | 4.68g | D. | 5.08g |
分析 Mg和Cu在反应中失去电子,最终生成Mg(OH)2和Cu(OH)2,则可知镁,铜失去电子的物质的量等于生成沉淀需要的氢氧根的物质的量,根据生成气体NO的物质的量,可知反应转移电子的物质的量,结合氧化还原反应得失电子数目相等,可知最终生成沉淀的质量.
解答 解:反应中Cu$\stackrel{2{e}^{-}}{→}$Cu2+$\stackrel{2O{H}^{-}}{→}$Cu(OH)2,Mg$\stackrel{2{e}^{-}}{→}$Mg2+$\stackrel{2O{H}^{-}}{→}$Mg(OH)2,则可知镁,铜失去电子的物质的量等于生成沉淀需要的氢氧根的物质的量,
根据HNO3$\stackrel{+3{e}^{-}}{→}$NO,HNO3$\stackrel{+{e}^{-}}{→}$NO2,HNO3$\stackrel{+4{e}^{-}}{→}$N2O,生成0.224LNO转移的电子数为$\frac{0.224L}{22.4L/mol}×3$=0.03mol,生成0.224LN2O转移的电子数=0.08mol,共转移电子0.12mol,所以反应后生成沉淀的质量为2.24g+0.12mol×17g/mol=4.28g,
故选B.
点评 本题考查混合物的计算,题目难度中等,本题注意把握转移电子的数目与氢氧根离子之间的关系,为解答该题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.下列仪器都不能用酒精灯直接加热的是( )
①烧杯 ②坩埚 ③蒸发皿 ④试管 ⑤蒸馏烧瓶 ⑥锥形瓶 ⑦燃烧匙.
①烧杯 ②坩埚 ③蒸发皿 ④试管 ⑤蒸馏烧瓶 ⑥锥形瓶 ⑦燃烧匙.
| A. | ③⑥⑦ | B. | ①⑤⑥ | C. | ②③⑤ | D. | ④⑤⑥⑦ |
12.有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阳离子和一种阴离子,且互不重复).
己知:①A、C溶液的pH均大于7,B溶液的pH小于7,A、B溶液中水的电离程度相同,D溶液的焰色反应(透过蓝色钴玻璃)显紫色.
②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成有刺激性气味的气体,A溶液和D溶液混合时无明显现象.
(1)A的化学式为CH3COONa.
(2)用离子方程式表不B溶液的pH小于7的原因:NH4++H2O?NH3•H2O+H+.
(3)写出C溶液和D溶液反应的离子方程式:Ba2++SO42-=BaSO4↓.
(4)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为c(OH-)>c(Ba2+)=c(Cl-)>c(NH4+)>c(H+).
| 阳离子 | K+、Na+、Ba2+、NH4+ |
| 阴离了 | CH3COO-、Cl-、OH-、SO42- |
②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成有刺激性气味的气体,A溶液和D溶液混合时无明显现象.
(1)A的化学式为CH3COONa.
(2)用离子方程式表不B溶液的pH小于7的原因:NH4++H2O?NH3•H2O+H+.
(3)写出C溶液和D溶液反应的离子方程式:Ba2++SO42-=BaSO4↓.
(4)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为c(OH-)>c(Ba2+)=c(Cl-)>c(NH4+)>c(H+).
13.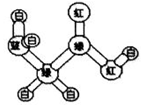 某期刊封面上有如下一个分子的球棍模型图:图中“棍”代表单键或双键或三键,不同颜色的球代表不同元素的原子.该模型图可代表一种( )
某期刊封面上有如下一个分子的球棍模型图:图中“棍”代表单键或双键或三键,不同颜色的球代表不同元素的原子.该模型图可代表一种( )
 某期刊封面上有如下一个分子的球棍模型图:图中“棍”代表单键或双键或三键,不同颜色的球代表不同元素的原子.该模型图可代表一种( )
某期刊封面上有如下一个分子的球棍模型图:图中“棍”代表单键或双键或三键,不同颜色的球代表不同元素的原子.该模型图可代表一种( )| A. | 卤代羧酸 | B. | 酯 | C. | 氨基酸 | D. | 醛 |
10.运用元素周期律分析下面的推断,其中不正确的是( )
| A. | 钾与水反应,比钠与水反应更剧烈 | |
| B. | 砹(At)为深色固体,AgAt也难溶于水也不溶于稀硝酸 | |
| C. | 在空气中加热,铷(Rb)的氧化产物比钠的氧化产物更复杂 | |
| D. | HClO的酸性比H2CO3的酸性强 |