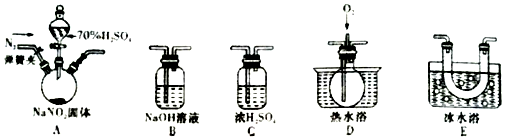
题目内容
18.膦(PH3)在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常含之.它的分子是三角锥形.以下关于PH3的叙述中,正确的是( )| A. | PH3是非极性分子 | |
| B. | PH3分子中有未成键的电子对 | |
| C. | PH3中的P-H键的极性比NH3中N-H键的极性弱 | |
| D. | PH3分子中的P-H键是非极性键 |
分析 A.正负电荷重心不重合的分子为极性分子,正负电荷重心重合的分子为非极性分子;
B.PH3分子中有1个未成键的孤对电子;
C.电负性相差越大,共价键的极性越强;
D.同种非金属元素之间存在非极性键,不同非金属元素之间存在极性键.
解答 解:A.该分子为三角锥型结构,正负电荷重心不重合,所以为极性分子,故A错误;
B.PH3分子P原子最外层有5个电子,其中3个电子和3个H原子形成共用电子对,所以该物质中有1个未成键的孤对电子,故B正确;
C.电负性相差越大,共价键的极性越强,则PH3中的P-H键的极性比NH3中N-H键的极性弱,故C正确;
D.同种非金属元素之间存在非极性键,不同非金属元素之间存在极性键,所以P-H原子之间存在极性键,故D错误;
故选BC.
点评 本题以膦为载体考查了物质的结构、化学键等知识点,以氨气分子为例采用知识迁移的方法进行分析解答,注意结合基本概念分析,题目难度不大.

练习册系列答案
相关题目
8.肼是一种常见的还原剂,不同条件下分解产物不同.60-300℃时,在Cu等金属表面肼分解的机理如图.
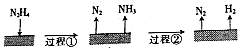
已知:200℃时:
Ⅰ.3N2H4(g)═N2(g)+4NH3(g)△H1=-32.9kJ•mol-1;
Ⅱ.N2H4(g)+H2(g)═2NH3(g)△H2=-41.8kJ•mol-1.
下列说法不正确的是( )

已知:200℃时:
Ⅰ.3N2H4(g)═N2(g)+4NH3(g)△H1=-32.9kJ•mol-1;
Ⅱ.N2H4(g)+H2(g)═2NH3(g)△H2=-41.8kJ•mol-1.
下列说法不正确的是( )
| A. | 肼属于共价化合物 | |
| B. | 图示过程①、②都是吸热反应 | |
| C. | 反应Ⅰ中氧化剂与还原剂的物质的量之比为2:1 | |
| D. | 200℃时,肼分解的热化学方程式为:N2H4(g)═N2(g)+2H2(g)△H═+50.7kJ•mol-1 |
13.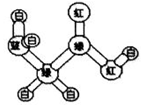 某期刊封面上有如下一个分子的球棍模型图:图中“棍”代表单键或双键或三键,不同颜色的球代表不同元素的原子.该模型图可代表一种( )
某期刊封面上有如下一个分子的球棍模型图:图中“棍”代表单键或双键或三键,不同颜色的球代表不同元素的原子.该模型图可代表一种( )
 某期刊封面上有如下一个分子的球棍模型图:图中“棍”代表单键或双键或三键,不同颜色的球代表不同元素的原子.该模型图可代表一种( )
某期刊封面上有如下一个分子的球棍模型图:图中“棍”代表单键或双键或三键,不同颜色的球代表不同元素的原子.该模型图可代表一种( )| A. | 卤代羧酸 | B. | 酯 | C. | 氨基酸 | D. | 醛 |
3.反应2NO+2CO $\frac{\underline{\;催化剂\;}}{△}$ N2+2CO2是汽车尾气的净化原理.下列判断正确的是( )
| A. | 该反应是置换反应 | B. | 该反应是复分解反应 | ||
| C. | CO发生氧化反应 | D. | NO是还原剂 |
10.运用元素周期律分析下面的推断,其中不正确的是( )
| A. | 钾与水反应,比钠与水反应更剧烈 | |
| B. | 砹(At)为深色固体,AgAt也难溶于水也不溶于稀硝酸 | |
| C. | 在空气中加热,铷(Rb)的氧化产物比钠的氧化产物更复杂 | |
| D. | HClO的酸性比H2CO3的酸性强 |
7.X2+和Y-与氩的电子层结构相同,下列判断中正确的是( )
| A. | 原子半径X<Y | |
| B. | 离子半径 X2+<Y- | |
| C. | X与Y的原子序数之差为8 | |
| D. | 在元素周期表中,两者处于同一周期 |
8.2015年2月,科学家首次观测到化学键的形成.下列粒子之间存在化学键的是( )
| A. | 质子与电子之间 | B. | 水分子与水分子之间 | ||
| C. | 氧分子中氧原子与氧原子之间 | D. | 氯化钠中钠离子与钠离子之间 |