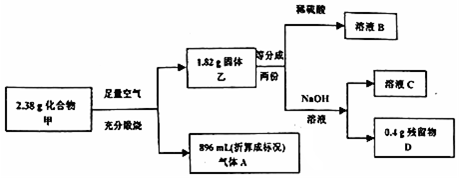
题目内容
10.工业生产会产生大量CO2,增加了碳排放量.人们一直努力将CO2变废为宝.途径一:将CO2催化加氢可制取乙烯.
已知:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H=-152kJ/mol
(1)化学键的键能如下表所示,则表中的x=612
| 化学键 | C=O | H-H | C=C | C-H | H-O |
| 键能/KJ mol | 803 | 436 | x | 414 | 464 |
请回答:
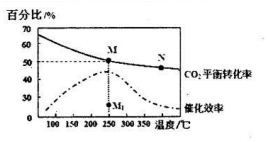
①计算250℃时该反应的化学平衡常数K=$\frac{0.125×0.{5}^{4}}{0.2{5}^{2}×0.7{5}^{6}}$(列出计算式即可).
②下列说法正确的是a
a.平衡常数大小:M>N
b.反应物活化分子百分数大小:M>N
c.当压强、混合气体的密度或$\frac{c({H}_{2})}{c(C{O}_{2})}$不变时均可视为化学反应已达到平衡状态
d.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于点M1
(3)下列措施一定可以提高平衡体系中C2H4百分含量,又能加快反应速率的是b
a.升高温度 b.缩小体积,增大压强
c.增大H2的浓度 d.将产物从反应体系中分离出来
途径二:以稀硫酸为电解质,利用电解原理将CO2转化为乙烯.
已知:该电解池的工作原理如图所示.
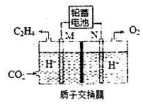
(4)M极上的电极反应式为2CO2+12H++12e-=CH2=CH2+4H2O.
(5)已知铅蓄电池放电时发生的反应为:PbO2+Pb+2H2SO4═2PbSO4+2H2O.若铅蓄电池中消耗1mol H2SO4,理论上能产生标准状况下C2H41.87L(结果保留两位小数).
(6)反应一段时间后,停止通电并撤掉交换膜使溶液充分混合.此时和电解前相比,硫酸溶液的pH变小(选填“变大”、“变小”或“不变”).
分析 (1)依据反应热=反应物总键能-生成物总能键能计算解答;
(2)①由图可知,250℃时CO2的平衡转化率为50%,利用三段式求出平衡时的浓度,再根据平衡常数表达式计算;
②a.该反应正方向为放热反应,升高温度逆向移动;
b.温度越高,反应物活化分子百分数越大;
c.混合气体的质量不变,体积不变,所以混合气体的密度始终不变;
d.根据图象分析;
(3)根据影响化学平衡的因素分析;
(4)由图可知M极由二氧化碳生成乙烯,则该极得电子发生氧化反应,据此书写;
(5)根据电子转移数目相等计算;
(6)根据总反应2CO2+2H2O?C2H4+3O2可知,混合后硫酸溶液的溶剂减少,酸性增强,pH减小.
解答 解:(1)反应热=反应物总键能-生成物总能键能,根据2CO2(g)+6H2(g)?C2H4(g)+4H2O(g),则△H=(4×804+12×436-4×414-X-8×464)kJ•mol-1=-152kJ•mol-1,解得X=612KJ/mol;
故答案为:612;
(2)①由图可知,250℃时CO2的平衡转化率为50%,则
2CO2(g)+6H2(g)?CH2=CH2(g)+4H2O(g)
c始:0.5 1.5 0 0
c转:0.25 0.75 0.125 0.5
c平:0.25 0.75 0.125 0.5
则平衡常数K=$\frac{0.125×0.{5}^{4}}{0.2{5}^{2}×0.7{5}^{6}}$;
故答案为:$\frac{0.125×0.{5}^{4}}{0.2{5}^{2}×0.7{5}^{6}}$;
②a.该反应正方向为放热反应,升高温度逆向移动,N点的温度大于M点,所以M点反应向正方向进行的程度大,即平衡常数大小:M>N,故a正确;
b.温度越高,反应物活化分子百分数越大,N点的温度高,所以反应物活化分子百分数大小:M<N,故b错误;
c.混合气体的质量不变,体积不变,所以混合气体的密度始终不变,所以不能根据混合气体的密度来判断化学反应是否达到平衡状态,故c错误;
d.由图象可知,其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于点M,故d错误;
故答案为:a;
(3)a.升高温度,有利于逆方向,平衡体系中C2H4百分含量降低,故a错误;
b.缩小体积,增大压强,反应速率加快,平衡正向移动,平衡体系中C2H4百分含量增加,故b正确;
c.增大H2的浓度,反应速率加快.平衡正向移动,有利于C2H4的生成,但是平衡体系中C2H4百分含量降低,故c错误;
d.将产物从反应体系中分离出来,反应速率减慢,故d错误;
故答案为:b;
(4)由图可知M极由二氧化碳生成乙烯,则该极得电子发生氧化反应,电极反应式为:2CO2+12H++12e-=CH2=CH2+4H2O;
故答案为:2CO2+12H++12e-=CH2=CH2+4H2O;
(5)已知铅蓄电池放电时发生的反应为:PbO2+Pb+2H2SO4═2PbSO4+2H2O.若铅蓄电池中消耗1mol H2SO4,则转移电子为1mol,根据2CO2+12H++12e-=CH2=CH2+4H2O,生成的乙烯为$\frac{1}{12}$mol,标况下的体积为$\frac{1}{12}$mol×22.4L/moL=1.87L;
故答案为:1.87;
(6)由图可知M极由二氧化碳生成乙烯,电极反应式为:2CO2+12H++12e-=CH2=CH2+4H2O,N极为溶液中水参与放电生成氧气,电极反应式为:2H2O-4e-=4H++O2,则总反应2CO2+2H2O?C2H4+3O2,混合后硫酸溶液的溶剂减少,酸性增强,pH变小;
故答案为:变小.
点评 本题考查了反应热与键能的关系、化学平衡移动的影响因素、化学平衡计算、电解池与原电池原理等,注意三段式在化学平衡计算中的灵活应用是解题的关键,侧重于考查学生对基础知识的综合应用能力、计算能力,题目难点中等.

| A. | NH4Cl | B. | H2O2 | C. | NaCl | D. | I2 |
| A. | ②③⑦ | B. | ①④⑥ | C. | ②③⑥ | D. | ①④⑤⑦ |
| A. | 常温常压下,7.8 gNa2O2含有的Na+数为0.2NA | |
| B. | 标准状况下,22.4 LCl2与水充分反应,转移的电子数为NA | |
| C. | 标准状况下,NA个CO2与SO2的混合气体分子占有的体积约为22.4 L | |
| D. | 50℃、1×105Pa下6g NO2与0℃、2×105 Pa下46 g N2O4均含有3NA个原子 |
| A. | 6种 | B. | 9种 | C. | 12种 | D. | 15种 |
 .
.