题目内容
18.氮的化合物丰富多彩.Ⅰ.(1)已知:氮化钠(Na2N)在温度高于37℃时分解为Na和N;
①Na2N(s)$\frac{\underline{\;\;△\;\;}}{\;}$ 3Na(s)+$\frac{1}{2}$N2(g)△H1=akJ/mol;
N2与Na反应生成的叠氮化钠(NaN3)
②2Na(s)+3N2(g)=Na2N(s),△H2=bkJ/mol;
③N2(g)+3H2(g)=2NH3(g),△H3=ckJ/mol;
请写出叠氮化钠(NaN3)与H3在催化剂作用下生成氮化钠(Na3N)和NH3(g)的热化学方程式:3NaN3(s)+12H2(g)=Na3N(s)+8NH3(g)△H=(4c-$\frac{3}{2}$b-a)kJ/mol.
Ⅱ.亚硝酸钠(NaNO2)是一种白色或淡黄色的粉水状工业盐.请回答下列问题:
(2)NaNO2既有氧化性有还原性,在酸性溶液中能与KI反应成单质碘和一种能与人体血红蛋白结合的气体,该反应的离子方程式为4H++2NO2-+2I-=I2+2NO↑+2H2O,若生成的气体在标准状况下的体积为11.2L,则反应中转移电子的物质的量为0.5mol.
(3)实验测得 0.1mol•L-1的NaNO2溶液的 pH 约为9,其原因是NO2-+H2O?HNO2+OH-.
(请用离子方程式表示),NaNO2溶液中各离子浓度由大到小的顺序为c(Na+)>c(NO2-)>c(OH-)>c(H+).
(4)AgNO2是一种微液溶于水,但能浓醋酸的白色固体,NaNO2也具有咸味,外观上和食盐无明显区别,鉴别食盐和NaNO2的实验操作是分别取少量的两种盐于试管中,分别滴加AgNO3溶液,然后再加入醋酸,若得到白色沉淀,则被检测的为食盐,若没有沉淀产生,则被检测的为NaNO2.
(5)工业上可利用NO、NO的混合气体与NaOH溶液反应制备NaNO2,该反成的化学方程式为NO2+NO+2NaOH═2NaNO2+H2O.
(6)亚硝酸钠加热分解放出有刺激性气味的气体,该气体可能是C(填字母).
A.N2B.NH3C.NO2D.SO2.
分析 (1)依据已知热化学方程式构建目标方程式,根据盖斯定律计算得到目标方程式的反应热;
(2)亚硝酸钠具有氧化性,酸性条件下能氧化碘离子生成碘,另一产物是一种能与人体血红蛋白结合的气体为一氧化氮;该反应中N化合价变化为(+3→+2),I化合价变化为(-1→0),根据得失电子守恒书写方程式和计算反应中转移电子数;
(3)亚硝酸钠是强碱弱酸盐,亚硝酸根离子水解而使其溶液呈碱性,据此判断NaNO2溶液中各离子浓度大小;
(4)根据亚硝酸钠和氯化钠的不同性质来进行区分;
(5)用NO、NO的混合气体与NaOH溶液反应制备NaNO2,为N元素的价态归中反应,根据得失电子守恒和原子守恒书写;
(6)根据质量守恒定律和N2、NH3、NO2、SO2的物理性质判断.
解答 解:(1)已知①Na3N(s)$\frac{\underline{\;\;△\;\;}}{\;}$ 3Na(s)+$\frac{1}{2}$N2(g)△H1=akJ/mol;
②2Na(s)+3N2(g)=Na3N(s),△H2=bkJ/mol;
③N2(g)+3H2(g)=2NH3(g),△H3=ckJ/mol;
叠氮化钠(NaN3)与H2在催化剂作用下生成氮化钠(Na3N)和NH3(g)的化学方程式为:3NaN3(s)+12H2(g)=Na3N(s)+8NH3(g),
由③×4-$\frac{3}{2}$×②-①可得,所以叠氮化钠(NaN3)与H2在催化剂作用下生成氮化钠(Na3N)和NH3(g)的热化学方程式为:3NaN3(s)+12H2(g)=Na3N(s)+8NH3(g)△H=(4c-$\frac{3}{2}$b-a)kJ/mol,
故答案为:3NaN3(s)+12H2(g)=Na3N(s)+8NH3(g)△H=(4c-$\frac{3}{2}$b-a)kJ/mol;
(2)在酸性溶液中亚硝酸钠能与KI反应成单质碘和一种能与人体血红蛋白结合的气体为NO,根据得失电子守恒和原子守恒,该反应的离子方程式为:4H++2NO2-+2I-=I2+2NO↑+2H2O,该反应中N化合价变化为(+3→+2),I化合价变化为(-1→0),若生成的气体在标准状况下的体积为11.2L,即生成0.5molNO,转移的电子数为0.5mol,
故答案为:4H++2NO2-+2I-=I2+2NO↑+2H2O;0.5mol;
(3)亚硝酸钠是强碱弱酸盐,亚硝酸根离子水解:NO2-+H2O?HNO2+OH-,溶液呈碱性,则c(OH-)>c(H+),所以离子浓度大小关系是c(Na+)>c(NO2-)>c(OH-)>c(H+),
故答案为:NO2-+H2O?HNO2+OH-;c(Na+)>c(NO2-)>c(OH-)>c(H+);
(4)AgNO2是一种微液溶于水的盐,但能溶于浓醋酸的白色固体,分别取少量的两种盐于试管中,分别滴加AgNO3溶液,然后再加入醋酸,若得到白色沉淀,则被检测的为食盐,白色沉淀为氯化银,若没有沉淀产生,则被检测的为NaNO2,
故答案为:分别取少量的两种盐于试管中,分别滴加AgNO3溶液,然后再加入醋酸,若得到白色沉淀,则被检测的为食盐,若没有沉淀产生,则被检测的为NaNO2;
(5)利用NO、NO2的混合气体与NaOH溶液反应制备NaNO2,N元素的化合价的变化为升高(+2→+3)、降低(+4→+3),根据得失电子守恒和原子守恒,该反成的化学方程式为:NO2+NO+2NaOH═2NaNO2+H2O,
故答案为:NO2+NO+2NaOH═2NaNO2+H2O;
(6)A.N2是无色无味的气体,故A错误;
B.根据质量守恒定律,反应物中不能含氢元素,不会生成NH3,故B错误;
C.NO2是红棕色有刺激性气味的气体,故C正确;
D.根据质量守恒定律,反应物中不能含硫元素,不会生成SO2,故D错误;
故选C.
点评 本题考查热化学方程式的书写、以电解质的电离为载体考查了离子浓度大小的比较物质的判断等知识点,明确物质的性质是解本题关键,题目难度中等.

 口算能手系列答案
口算能手系列答案| A. | 香水挥发 | B. | 海水晒盐 | ||
| C. | 冷、浓硝酸使铁片钝化 | D. | 干冰升华 |
途径一:将CO2催化加氢可制取乙烯.
已知:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H=-152kJ/mol
(1)化学键的键能如下表所示,则表中的x=612
| 化学键 | C=O | H-H | C=C | C-H | H-O |
| 键能/KJ mol | 803 | 436 | x | 414 | 464 |
请回答:
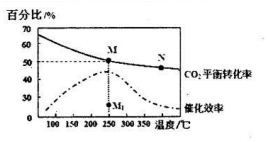
①计算250℃时该反应的化学平衡常数K=$\frac{0.125×0.{5}^{4}}{0.2{5}^{2}×0.7{5}^{6}}$(列出计算式即可).
②下列说法正确的是a
a.平衡常数大小:M>N
b.反应物活化分子百分数大小:M>N
c.当压强、混合气体的密度或$\frac{c({H}_{2})}{c(C{O}_{2})}$不变时均可视为化学反应已达到平衡状态
d.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于点M1
(3)下列措施一定可以提高平衡体系中C2H4百分含量,又能加快反应速率的是b
a.升高温度 b.缩小体积,增大压强
c.增大H2的浓度 d.将产物从反应体系中分离出来
途径二:以稀硫酸为电解质,利用电解原理将CO2转化为乙烯.
已知:该电解池的工作原理如图所示.
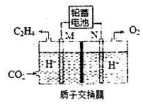
(4)M极上的电极反应式为2CO2+12H++12e-=CH2=CH2+4H2O.
(5)已知铅蓄电池放电时发生的反应为:PbO2+Pb+2H2SO4═2PbSO4+2H2O.若铅蓄电池中消耗1mol H2SO4,理论上能产生标准状况下C2H41.87L(结果保留两位小数).
(6)反应一段时间后,停止通电并撤掉交换膜使溶液充分混合.此时和电解前相比,硫酸溶液的pH变小(选填“变大”、“变小”或“不变”).
| A. | 2AlCl3(熔融)$\frac{\underline{\;电解\;}}{\;}$2Al+3Cl2↑ | |
| B. | 电解CuCl2溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+4H++O2↑ | |
| C. | 硫酸氢铵溶液与足量烧碱稀溶液共热:NH4++H++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O | |
| D. | Cu和AgNO3溶液反应:Cu+Ag+═Cu2++Ag |
| A. | 180 kJ | B. | 220 kJ | C. | 240 kJ | D. | 280 kJ |
| A. | 用萃取的方法分离汽油和煤油 | |
| B. | 用NaOH溶液除去二氧化碳中的一氧化碳气体 | |
| C. | 加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铁粉 | |
| D. | 要鉴别水中是否有氯离子,可加入AgNO3溶液,观察是否产生白色沉淀 |
| A. | 羟基的电子式: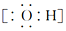 | B. | 乙酸的分子式:CH3COOH | ||
| C. | 溴乙烷的结构简式:CH2BrCH2Br | D. | 乙炔的实验式:CH |
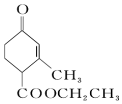 和
和  ,前者不含氧的官能团为(写结构简式)羰基、酯基,后者官能团有(写名称)酯基、羟基;
,前者不含氧的官能团为(写结构简式)羰基、酯基,后者官能团有(写名称)酯基、羟基;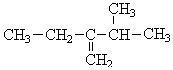 的名称为3-甲基-2-乙基-1-丁烯,
的名称为3-甲基-2-乙基-1-丁烯,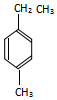 的名称为对甲基乙苯;
的名称为对甲基乙苯;