题目内容
1.下列物质分子中,各原子不处于同一平面的是:①甲苯;②乙炔;③乙烯;④乙烷;⑤甲烷;⑥苯;⑦丙烯.( )| A. | ②③⑦ | B. | ①④⑥ | C. | ②③⑥ | D. | ①④⑤⑦ |
分析 碳碳双键、苯环为平面结构,碳碳三键为直线结构,含甲基、亚甲基等为四面体结构,以此来解答.
解答 解:②乙炔、③乙烯、⑥苯为平面结构,①甲苯、④乙烷、⑤甲烷、⑦丙烯中均含甲基,甲基为四面体结构,则所有原子不处于同一平面,
故选D.
点评 本题考查有机物的结构,为高频考点,把握常见有机物的结构为解答的关键,侧重分析与应用能力的考查,注意甲烷中C为sp3杂化形成的空间构型,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.下列说法正确的是( )
| A. | 苯在一定条件下可以和H2反应 | B. | 甲烷和乙醇都属于饱和烃 | ||
| C. | 一氯甲烷分子式为CH4Cl | D. | 乙烷和乙烯是同系物 |
9.下列过程发生化学变化的是( )
| A. | 香水挥发 | B. | 海水晒盐 | ||
| C. | 冷、浓硝酸使铁片钝化 | D. | 干冰升华 |
16.“低碳经济,节能减排”是当今世界经济发展的新思路.”下列与之相悖的是( )
| A. | 着力开发风能、太阳能、地热能等清洁高效新能源,减少煤、石油等化石燃料的使用 | |
| B. | 为了减少SO2和NOx的排放,工业废气排放到大气之前必须回收处理 | |
| C. | 大力开采煤、石油和天然气,以满足经济发展和日常生活的需要 | |
| D. | 大力发展混合动力汽车、电动汽车等新能源汽车,以减少对化石能源的依赖,保护城乡环境,关爱人类生存空间 |
6.R原子的质量数为Y,mgR2-中含有电子Xmol.则R原子核内中子数为( )
| A. | $\frac{mY-XY+2m}{m}$ | B. | Y-X+2 | C. | $\frac{mY+XY-2m}{m}$ | D. | Y-X-2 |
10.工业生产会产生大量CO2,增加了碳排放量.人们一直努力将CO2变废为宝.
途径一:将CO2催化加氢可制取乙烯.
已知:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H=-152kJ/mol
(1)化学键的键能如下表所示,则表中的x=612
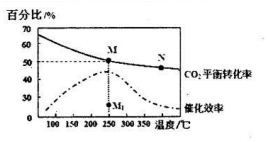
(2)如图所示为在体积为2L的恒容容器中,投料为1 mol CO2和3mol H2时,测得温度对CO2的平衡转化率和催化剂催化效率的影响.
请回答:
①计算250℃时该反应的化学平衡常数K=$\frac{0.125×0.{5}^{4}}{0.2{5}^{2}×0.7{5}^{6}}$(列出计算式即可).
②下列说法正确的是a
a.平衡常数大小:M>N
b.反应物活化分子百分数大小:M>N
c.当压强、混合气体的密度或$\frac{c({H}_{2})}{c(C{O}_{2})}$不变时均可视为化学反应已达到平衡状态
d.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于点M1
(3)下列措施一定可以提高平衡体系中C2H4百分含量,又能加快反应速率的是b
a.升高温度 b.缩小体积,增大压强
c.增大H2的浓度 d.将产物从反应体系中分离出来
途径二:以稀硫酸为电解质,利用电解原理将CO2转化为乙烯.
已知:该电解池的工作原理如图所示.
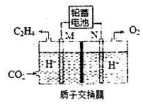
(4)M极上的电极反应式为2CO2+12H++12e-=CH2=CH2+4H2O.
(5)已知铅蓄电池放电时发生的反应为:PbO2+Pb+2H2SO4═2PbSO4+2H2O.若铅蓄电池中消耗1mol H2SO4,理论上能产生标准状况下C2H41.87L(结果保留两位小数).
(6)反应一段时间后,停止通电并撤掉交换膜使溶液充分混合.此时和电解前相比,硫酸溶液的pH变小(选填“变大”、“变小”或“不变”).
途径一:将CO2催化加氢可制取乙烯.
已知:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H=-152kJ/mol
(1)化学键的键能如下表所示,则表中的x=612
| 化学键 | C=O | H-H | C=C | C-H | H-O |
| 键能/KJ mol | 803 | 436 | x | 414 | 464 |

请回答:
①计算250℃时该反应的化学平衡常数K=$\frac{0.125×0.{5}^{4}}{0.2{5}^{2}×0.7{5}^{6}}$(列出计算式即可).
②下列说法正确的是a
a.平衡常数大小:M>N
b.反应物活化分子百分数大小:M>N
c.当压强、混合气体的密度或$\frac{c({H}_{2})}{c(C{O}_{2})}$不变时均可视为化学反应已达到平衡状态
d.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于点M1
(3)下列措施一定可以提高平衡体系中C2H4百分含量,又能加快反应速率的是b
a.升高温度 b.缩小体积,增大压强
c.增大H2的浓度 d.将产物从反应体系中分离出来
途径二:以稀硫酸为电解质,利用电解原理将CO2转化为乙烯.
已知:该电解池的工作原理如图所示.

(4)M极上的电极反应式为2CO2+12H++12e-=CH2=CH2+4H2O.
(5)已知铅蓄电池放电时发生的反应为:PbO2+Pb+2H2SO4═2PbSO4+2H2O.若铅蓄电池中消耗1mol H2SO4,理论上能产生标准状况下C2H41.87L(结果保留两位小数).
(6)反应一段时间后,停止通电并撤掉交换膜使溶液充分混合.此时和电解前相比,硫酸溶液的pH变小(选填“变大”、“变小”或“不变”).
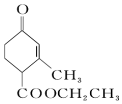 和
和  ,前者不含氧的官能团为(写结构简式)羰基、酯基,后者官能团有(写名称)酯基、羟基;
,前者不含氧的官能团为(写结构简式)羰基、酯基,后者官能团有(写名称)酯基、羟基;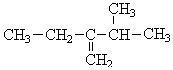 的名称为3-甲基-2-乙基-1-丁烯,
的名称为3-甲基-2-乙基-1-丁烯,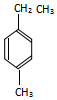 的名称为对甲基乙苯;
的名称为对甲基乙苯;