题目内容
18.用NA表示阿伏加德罗常数,下列叙述不正确的是( )| A. | 常温常压下,7.8 gNa2O2含有的Na+数为0.2NA | |
| B. | 标准状况下,22.4 LCl2与水充分反应,转移的电子数为NA | |
| C. | 标准状况下,NA个CO2与SO2的混合气体分子占有的体积约为22.4 L | |
| D. | 50℃、1×105Pa下6g NO2与0℃、2×105 Pa下46 g N2O4均含有3NA个原子 |
分析 A、求出过氧化钠的物质的量,然后根据过氧化钠中含2个钠离子来分析;
B、求出氯气的物质的量,然后根据氯气和水的反应为可逆反应来分析;
C、求出混合气体的物质的量,然后根据气体体积V=nVm来计算;
D、NO2和N2O4的最简式均为NO2.
解答 解:A、7.8g过氧化钠的物质的量n=$\frac{7.8g}{78g/mol}$=0.1mol,而过氧化钠中含2个钠离子,故0.1mol过氧化钠中含0.2NA个钠离子,故A正确;
B、标况下22.4L氯气的物质的量为1mol,而氯气和水的反应为可逆反应,不能进行彻底,故转移的电子数小于NA个,故B错误;
C、含NA个CO2与SO2的分子的混合气体的物质的量n=$\frac{{N}_{A}}{{N}_{A}/mol}$=1mol,在标况下的气体体积V=nVm=1mol×22.4L/mol=22.4L,故C正确;
D、NO2和N2O4的最简式均为NO2,故50℃、1×105Pa下46g NO2与0℃、2×105 Pa下46 g N2O4中含有的NO2的物质的量均为1mol,则均含3NA个原子,故D正确.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
相关题目
8.某无色水溶液可能含有以下离子中的若干种:NH4+、Cl-、Fe2+、Ba2+、K+、CO32-、SO42-,现取三份100mL 的该溶液进行如下实验:①第一份加入AgNO3溶液有沉淀产生;②第二份加足量NaOH溶液加热后,收集到气体0.04mol; ③第三份加足量BaCl2溶液后,得干燥沉淀6.27g,用足量盐酸洗涤、干燥后,剩余沉淀质量为2.33g.根据上述实验结果推测以下说法不正确的是( )
| A. | K+一定存在 | B. | 溶液中CO32-浓度为0.1 mol/L | ||
| C. | Cl-可能存在 | D. | Ba2+一定不存在 |
9.下列过程发生化学变化的是( )
| A. | 香水挥发 | B. | 海水晒盐 | ||
| C. | 冷、浓硝酸使铁片钝化 | D. | 干冰升华 |
6.R原子的质量数为Y,mgR2-中含有电子Xmol.则R原子核内中子数为( )
| A. | $\frac{mY-XY+2m}{m}$ | B. | Y-X+2 | C. | $\frac{mY+XY-2m}{m}$ | D. | Y-X-2 |
10.工业生产会产生大量CO2,增加了碳排放量.人们一直努力将CO2变废为宝.
途径一:将CO2催化加氢可制取乙烯.
已知:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H=-152kJ/mol
(1)化学键的键能如下表所示,则表中的x=612
(2)如图所示为在体积为2L的恒容容器中,投料为1 mol CO2和3mol H2时,测得温度对CO2的平衡转化率和催化剂催化效率的影响.
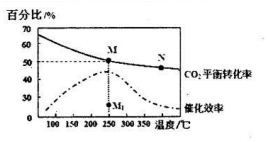
请回答:
①计算250℃时该反应的化学平衡常数K=$\frac{0.125×0.{5}^{4}}{0.2{5}^{2}×0.7{5}^{6}}$(列出计算式即可).
②下列说法正确的是a
a.平衡常数大小:M>N
b.反应物活化分子百分数大小:M>N
c.当压强、混合气体的密度或$\frac{c({H}_{2})}{c(C{O}_{2})}$不变时均可视为化学反应已达到平衡状态
d.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于点M1
(3)下列措施一定可以提高平衡体系中C2H4百分含量,又能加快反应速率的是b
a.升高温度 b.缩小体积,增大压强
c.增大H2的浓度 d.将产物从反应体系中分离出来
途径二:以稀硫酸为电解质,利用电解原理将CO2转化为乙烯.
已知:该电解池的工作原理如图所示.
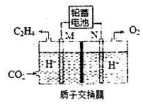
(4)M极上的电极反应式为2CO2+12H++12e-=CH2=CH2+4H2O.
(5)已知铅蓄电池放电时发生的反应为:PbO2+Pb+2H2SO4═2PbSO4+2H2O.若铅蓄电池中消耗1mol H2SO4,理论上能产生标准状况下C2H41.87L(结果保留两位小数).
(6)反应一段时间后,停止通电并撤掉交换膜使溶液充分混合.此时和电解前相比,硫酸溶液的pH变小(选填“变大”、“变小”或“不变”).
途径一:将CO2催化加氢可制取乙烯.
已知:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H=-152kJ/mol
(1)化学键的键能如下表所示,则表中的x=612
| 化学键 | C=O | H-H | C=C | C-H | H-O |
| 键能/KJ mol | 803 | 436 | x | 414 | 464 |

请回答:
①计算250℃时该反应的化学平衡常数K=$\frac{0.125×0.{5}^{4}}{0.2{5}^{2}×0.7{5}^{6}}$(列出计算式即可).
②下列说法正确的是a
a.平衡常数大小:M>N
b.反应物活化分子百分数大小:M>N
c.当压强、混合气体的密度或$\frac{c({H}_{2})}{c(C{O}_{2})}$不变时均可视为化学反应已达到平衡状态
d.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于点M1
(3)下列措施一定可以提高平衡体系中C2H4百分含量,又能加快反应速率的是b
a.升高温度 b.缩小体积,增大压强
c.增大H2的浓度 d.将产物从反应体系中分离出来
途径二:以稀硫酸为电解质,利用电解原理将CO2转化为乙烯.
已知:该电解池的工作原理如图所示.

(4)M极上的电极反应式为2CO2+12H++12e-=CH2=CH2+4H2O.
(5)已知铅蓄电池放电时发生的反应为:PbO2+Pb+2H2SO4═2PbSO4+2H2O.若铅蓄电池中消耗1mol H2SO4,理论上能产生标准状况下C2H41.87L(结果保留两位小数).
(6)反应一段时间后,停止通电并撤掉交换膜使溶液充分混合.此时和电解前相比,硫酸溶液的pH变小(选填“变大”、“变小”或“不变”).
6.下列离子方程式或化学方程式书写正确的是( )
| A. | 2AlCl3(熔融)$\frac{\underline{\;电解\;}}{\;}$2Al+3Cl2↑ | |
| B. | 电解CuCl2溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+4H++O2↑ | |
| C. | 硫酸氢铵溶液与足量烧碱稀溶液共热:NH4++H++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O | |
| D. | Cu和AgNO3溶液反应:Cu+Ag+═Cu2++Ag |
7.下列实验方案可行的是( )
| A. | 用萃取的方法分离汽油和煤油 | |
| B. | 用NaOH溶液除去二氧化碳中的一氧化碳气体 | |
| C. | 加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铁粉 | |
| D. | 要鉴别水中是否有氯离子,可加入AgNO3溶液,观察是否产生白色沉淀 |