题目内容
15.Ⅰ.过氧化钡常温下缓慢分解,不溶于水,常用作氧化剂、漂白剂等.请回答下列问题:(1)BaO2的电子式为
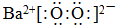 .
.(2)BaCl2在氨水中与H2O2反应可得到BaO2沉淀,用一个离子反应方程式表示该原理为Ba2++H2O2+2NH3•H2O=BaO2+2NH4++2H2O.
(3)配平下列反应方程式:2MnO4-+5BaO2+16H+═5Ba2++2Mn2++5O2↑+8H2O.
Ⅱ.化合物甲由三种元素组成,某研究性学习小组按如图流程探究其组成:
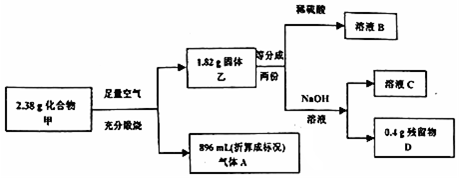
Ⅲ.已知:气体A能使品红溶液褪色,加热后品红溶液恢复至原色.取少量溶液B,滴加KSCN溶液,发现溶液变为血红色. 请推测并回答:
(4)用离子反应方程式解释溶液变为血红色的原因:Fe3++3SCN-=Fe(SCN)3.
(5)写出形成溶液C的化学方程式:Al2O3+2NaOH=2NaAlO2+H2O.
(6)写出气体A通入溶液B中,发生氧化还原的离子反应方程式:2H2O+2Fe3++SO2=2Fe2++SO42-+4H+.
(7)写出化合物甲的化学式FeAl2S4.
分析 Ⅰ.(1)依据过氧化钠结构可知过氧化钡中钡离子与过氧根离子通过离子键结合,过氧根中两个氧原子通过共价键结合;
(2)依据题干可知:BaCl2在氨水中与H2O2反应生成BaO2沉淀和氯化铵和水;
(3)反应中+7价锰化合价降为+2价,过氧化钡中-1价氧化升高为氧气中0价,依据氧化还原反应得失电子守恒结合原子个数守恒配比书写方程式;
Ⅲ.2.38g化合物甲,在空气中充分煅烧后,得固体残留物乙1.82g和标准状况下896mL即0.04mol气体A,该气体能使品红溶液褪色,加热后品红溶液恢复至原色,所以A是SO2,所得固体残留物乙能全部溶于稀硫酸得溶液B,加KSCN溶液,发现溶液变为血红色,所以B是硫酸铁溶液,固体残留物中存在氧化铁,固体残留物部分溶于NaOH溶液中,所以一定含有氧化铝,固体残留物乙1.82g是氧化铝和氧化铁的混合物,其中Fe2O3是0.8g,Al2O3是1.82g-0.8g=1.02g,据此推断化合物甲中一定含有的元素是Fe、Al、S,n(Al)=$\frac{1.02}{102}×2$=0.02mol,n(Fe)=$\frac{0.8}{160}×2$=0.01mol,n(S)=0.04mol,得到物质的分子式,根据物质的性质进行回答即可.
解答 解:Ⅰ.(1)过氧化钡中,钡离子与过氧根离子通过离子键结合,氧原子之间通过共价键结合,过氧化钡的电子式: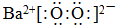 ;
;
故答案为: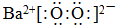 ;
;
(2)BaCl2在氨水中与H2O2反应生成BaO2沉淀和氯化铵和水,离子方程式:Ba2++H2O2+2NH3•H2O=BaO2+2NH4++2H2O;
故答案为:Ba2++H2O2+2NH3•H2O=BaO2+2NH4++2H2O;
(3)反应中+7价锰化合价降为+2价,过氧化钡中-1价氧化升高为氧气中0价,要使得失电子守恒则高锰酸根离子系数为2,过氧化钡系数为5,依据原子个数守恒,反应的方程式:2MnO4-+5BaO2+16H+=2Mn2++5O2↑+5Ba2++8H2O;
故答案为:2;5;16H+;5;2;5;8;
Ⅲ.(4)取少量溶液B,滴加KSCN溶液,发现溶液变为血红色,说明B中含有+3价Fe,反应离子方程式为:Fe3++3SCN-=Fe(SCN)3;故答案为:Fe3++3SCN-=Fe(SCN)3;
(5)氧化铝能与氢氧化钠反应生成溶液C,则反应的化学方程式为:Al2O3+2NaOH=2NaAlO2+H2O,故答案为:Al2O3+2NaOH=2NaAlO2+H2O;
(6)根据以上分析,A为SO2,B为Fe2(SO4)3,则A通入溶液B中,发生氧化还原的离子反应方程式为:2H2O+2Fe3++SO2=2Fe2++SO42-+4H+,故答案为:2H2O+2Fe3++SO2=2Fe2++SO42-+4H+;
(7)根据以上分析,n(Al)=$\frac{1.02g}{102g/moL}×2$=0.02mol,n(Fe)=$\frac{0.8g}{160g/moL}×2$=0.01mol,n(S)=0.04mol,则化合物甲中n(Fe):n(Al):n(S)=0.005×2:0.01×2:0.04=1:2:4,所以化学式为:FeAl2S4,故答案为:FeAl2S4.
点评 本题考查了电子式、化学方程式书写,以及物质的分子式的计算,注意物质的性质以及发生反应方程式的书写是关键,学会元素守恒思想的应用是重点,难度中等.

| A. | $\frac{mY-XY+2m}{m}$ | B. | Y-X+2 | C. | $\frac{mY+XY-2m}{m}$ | D. | Y-X-2 |
途径一:将CO2催化加氢可制取乙烯.
已知:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H=-152kJ/mol
(1)化学键的键能如下表所示,则表中的x=612
| 化学键 | C=O | H-H | C=C | C-H | H-O |
| 键能/KJ mol | 803 | 436 | x | 414 | 464 |
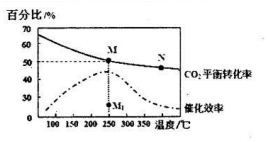
请回答:
①计算250℃时该反应的化学平衡常数K=$\frac{0.125×0.{5}^{4}}{0.2{5}^{2}×0.7{5}^{6}}$(列出计算式即可).
②下列说法正确的是a
a.平衡常数大小:M>N
b.反应物活化分子百分数大小:M>N
c.当压强、混合气体的密度或$\frac{c({H}_{2})}{c(C{O}_{2})}$不变时均可视为化学反应已达到平衡状态
d.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于点M1
(3)下列措施一定可以提高平衡体系中C2H4百分含量,又能加快反应速率的是b
a.升高温度 b.缩小体积,增大压强
c.增大H2的浓度 d.将产物从反应体系中分离出来
途径二:以稀硫酸为电解质,利用电解原理将CO2转化为乙烯.
已知:该电解池的工作原理如图所示.
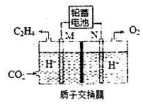
(4)M极上的电极反应式为2CO2+12H++12e-=CH2=CH2+4H2O.
(5)已知铅蓄电池放电时发生的反应为:PbO2+Pb+2H2SO4═2PbSO4+2H2O.若铅蓄电池中消耗1mol H2SO4,理论上能产生标准状况下C2H41.87L(结果保留两位小数).
(6)反应一段时间后,停止通电并撤掉交换膜使溶液充分混合.此时和电解前相比,硫酸溶液的pH变小(选填“变大”、“变小”或“不变”).
| A. | 2AlCl3(熔融)$\frac{\underline{\;电解\;}}{\;}$2Al+3Cl2↑ | |
| B. | 电解CuCl2溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+4H++O2↑ | |
| C. | 硫酸氢铵溶液与足量烧碱稀溶液共热:NH4++H++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O | |
| D. | Cu和AgNO3溶液反应:Cu+Ag+═Cu2++Ag |
| A. | 180 kJ | B. | 220 kJ | C. | 240 kJ | D. | 280 kJ |
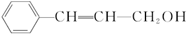 ,则对该有机物的说法正确的是( )
,则对该有机物的说法正确的是( )| A. | 能使溴水、酸性高锰酸钾溶液褪色 | |
| B. | 分子中所有原子在同一平面内 | |
| C. | 分子式为C9H12O | |
| D. | 能发生加成反应、酯化反应、水解反应 |
 ;与M同一周期的主族元素中原子半径最小的是(填元素符号)Cl.
;与M同一周期的主族元素中原子半径最小的是(填元素符号)Cl. .
.