题目内容
1.工业上利用硫黄生产硫酸的步骤及反应为:①造气:S(s)+O2(g)$\frac{\underline{\;高温\;}}{\;}$SO2(g);
②催化氧化:2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g);
③吸收:SO3(g)+H2O(l)═H2SO4(l).
(1)根据图1写出S(s)与O2(g)反应生成SO3(g)的热化学方程式:S(g)+$\frac{3}{2}$O2(g)?SO3(g)△H=-395.7kJ•mol-1.
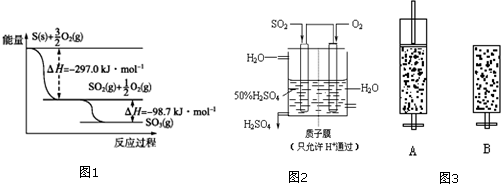
(2)某温度下SO2(g)+$\frac{1}{2}$O2(g)?SO3(g);△H=-98kJ/mol.开始时在10L的密闭容器中加入4.0molSO2(g)和5.0molO2(g),当反应达到平衡时共放出热量196kJ,求该温度下2SO2(g)+O2(g)?2SO3(g)平衡常数K=$\frac{\sqrt{10}}{2}$.
(3)某人设想以图2所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:SO2-2e-+2H2O=SO42-+4H+.
(4)有两只密闭容器A和B,A容器有一移动的活塞能使容器内保持恒压,B容器能保持恒容,起始向这两只容器中分别充入等量的体积比为2:1的SO2和O2的混合气体,并使A和B容积相等(如图3),400℃时发生如下反应:2SO2+O2?2SO3
填写下列空格.
①A容器中SO2的转化率比B容器大
②达到①所述平衡后,若向两容器通入等量的原反应气体,达到平衡时A容器中SO3的体积分数不变(增大、减小、不变),B容器中SO3的体积分数增大(增大、减小、不变)
(5)对于反应2SO2(g)+O2(g)?2SO3(g),一定条件下达到平衡后,在保证O2浓度不变的情况下,增大容器的体积,试根据平衡常数,判断平衡不移动.(填“正向移动”、“逆向移动”或“不移动”)
分析 (1)分析图象能量变化,写出化学方程式,标注物质聚集状态和反应焓变写出热化学方程式
(2)根据反应达到平衡过程中放出的热量计算出转化的SO2的物质的量,确定平衡状态,再计算平衡常数;
(3)燃料电池能氧气的极为正极,通SO2的极为负极,发生氧化反应,据此书写电极反应式;
(4)①根据化学反应速率越快,到达平衡的时间越短;利用等效平衡来判断平衡移动来解答;
②根据浓度对化学平衡的影响,求出平衡移动后SO3的体积分数;
(5)平衡常数的影响因素为温度,温度不变,在此基础上,增大容器的体积,但O2的浓度不变,相当于恒压恒温条件下,成比例增大反应物的量,由此判断平衡的移动方向.
解答 解:(1)依据图象分析结合反应能量变化,写出化学方程式,标注物质聚集状态和反应热,S和O2生成SO3的热化学方程式为:S(g)+$\frac{3}{2}$O2(g)?SO3(g)△H=(-297.0kJ•mol-1)+(-98.7kJ•mol-1)=-395.7kJ•mol-1,
故答案为:S(g)+$\frac{3}{2}$O2(g)?SO3(g)△H=-395.7kJ•mol-1;
(2)当反应达到平衡时共放出热量196kJ,则变化的SO2的物质的量为$\frac{196kJ}{98kJ/mol}$=2mol,
SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)
起始物质的量(mol) 4 5 0
变化物质的量(mol) 2 1 2
平衡物质的量(mol) 2 4 2
此时平衡常数K=$\frac{c(S{O}_{3})}{c(S{O}_{2})×{c}^{\frac{1}{2}}({O}_{2})}$=$\frac{(\frac{2mol}{10L})}{(\frac{2mol}{10L})×(\frac{4mol}{10L})^{\frac{1}{2}}}$=$\frac{\sqrt{10}}{2}$,
故答案为:$\frac{\sqrt{10}}{2}$;
(3)通SO的极是负极,发生氧化反应,其电极反应为:SO2-2e-+2H2O=SO42-+4H+,故答案为:SO2-2e-+2H2O=SO42-+4H+;
(4)①若A容器保持恒容,两容器建立的平衡等效,而实际上A容器体积减少,压强增大,平衡向正反应方向移动,所以A中SO2的转化率比B大,
故答案为:大;
②向两容器中通入等量的原反应气体,达到平衡后,A中建立的平衡与原平衡等效,所以SO3的体积分数不变,B容器中建立的平衡相当于在原平衡的基础上增大压强,平衡正向移动,B容器中SO3的体积分数增大,
故答案为:不变;增大;
(5)在保证O2浓度不变的情况下,增大容器的体积,此时温度不变,平衡常数不变,相当于将同等平衡状态在恒温恒容条件下回合在一起,平衡不移动,故答案为:不移动.
点评 本题考查化学平衡移动及影响因素,涉及平衡常数的计算、热化学方程式的书写等,本题难度中等,注意等效平衡的理解和应用,掌握基础是解题关键.

| A. | 苯在一定条件下可以和H2反应 | B. | 甲烷和乙醇都属于饱和烃 | ||
| C. | 一氯甲烷分子式为CH4Cl | D. | 乙烷和乙烯是同系物 |
途径一:将CO2催化加氢可制取乙烯.
已知:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H=-152kJ/mol
(1)化学键的键能如下表所示,则表中的x=612
| 化学键 | C=O | H-H | C=C | C-H | H-O |
| 键能/KJ mol | 803 | 436 | x | 414 | 464 |
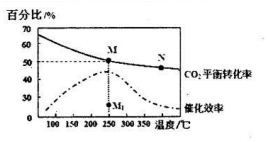
请回答:
①计算250℃时该反应的化学平衡常数K=$\frac{0.125×0.{5}^{4}}{0.2{5}^{2}×0.7{5}^{6}}$(列出计算式即可).
②下列说法正确的是a
a.平衡常数大小:M>N
b.反应物活化分子百分数大小:M>N
c.当压强、混合气体的密度或$\frac{c({H}_{2})}{c(C{O}_{2})}$不变时均可视为化学反应已达到平衡状态
d.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于点M1
(3)下列措施一定可以提高平衡体系中C2H4百分含量,又能加快反应速率的是b
a.升高温度 b.缩小体积,增大压强
c.增大H2的浓度 d.将产物从反应体系中分离出来
途径二:以稀硫酸为电解质,利用电解原理将CO2转化为乙烯.
已知:该电解池的工作原理如图所示.
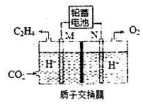
(4)M极上的电极反应式为2CO2+12H++12e-=CH2=CH2+4H2O.
(5)已知铅蓄电池放电时发生的反应为:PbO2+Pb+2H2SO4═2PbSO4+2H2O.若铅蓄电池中消耗1mol H2SO4,理论上能产生标准状况下C2H41.87L(结果保留两位小数).
(6)反应一段时间后,停止通电并撤掉交换膜使溶液充分混合.此时和电解前相比,硫酸溶液的pH变小(选填“变大”、“变小”或“不变”).
| A. | 无色溶液中可能大量存在Al3+、NH4+、Cl-、S2- | |
| B. | pH=1的溶液中大量存在Na+、NH4+、SiO32-、I- | |
| C. | 弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3- | |
| D. | 0.1mol•L-1NaAlO2溶液中可能大量存在Na+、H+、Cl-、SO42- |
| A. | 2AlCl3(熔融)$\frac{\underline{\;电解\;}}{\;}$2Al+3Cl2↑ | |
| B. | 电解CuCl2溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+4H++O2↑ | |
| C. | 硫酸氢铵溶液与足量烧碱稀溶液共热:NH4++H++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O | |
| D. | Cu和AgNO3溶液反应:Cu+Ag+═Cu2++Ag |
 在2L恒容密闭容器中,发生反应 2NO(g)+O2(g)?2NO2(g).
在2L恒容密闭容器中,发生反应 2NO(g)+O2(g)?2NO2(g).(1)某温度时,按物质的量比2:1充入NO和O2开始反应,n(NO)随时间变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.007 | 0.006 | 0.006 | 0.006 |
(2)该反应的平衡常数表达式为K=$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)×c({O}_{2})}$.能说明该反应已达到平衡状态的是ABC.
A.气体颜色保持不变 B.气体平均相对分子质量保持不变
C.υ逆(NO)=2υ正(O2)D.气体密度保持不变
(3)已知:K300℃>K400℃.下列措施能使该反应的反应速率增大且平衡向正反应方向移动的是C.
A.升高温度 B.充入Ar使压强增大 C.充入O2使压强增大 D.选择高效催化剂
(4)将amolNO和bmolO2发生反应,要使反应物和生成物物质的量之比为1:2,则a/b的取值范围是1<$\frac{a}{b}$<3.
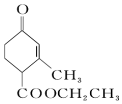 和
和  ,前者不含氧的官能团为(写结构简式)羰基、酯基,后者官能团有(写名称)酯基、羟基;
,前者不含氧的官能团为(写结构简式)羰基、酯基,后者官能团有(写名称)酯基、羟基;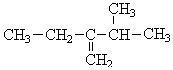 的名称为3-甲基-2-乙基-1-丁烯,
的名称为3-甲基-2-乙基-1-丁烯,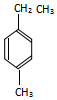 的名称为对甲基乙苯;
的名称为对甲基乙苯;