题目内容
12.煤的气化主要反应是煤中碳与水蒸气反应生成CO、H2等,回答下列问题:(1)CO和H2分别与O2都可以设计成燃料电池,CO与O2设计成燃料电池(以熔融碳酸盐为电解质)负极的电极反应为CO-2e-+CO32-=2CO2
(2)在煤的气化获得的化工原料气中含有少量羰基硫(COS),能引起催化中毒、大气污染等,COS的电子式为
 羰基硫与烧碱溶液反应生成水和两种正盐的离子方程式为COS+4NaOH=Na2S+Na2CO3+2H2O羰基硫的脱硫常用两种方法,其反应式分别为:
羰基硫与烧碱溶液反应生成水和两种正盐的离子方程式为COS+4NaOH=Na2S+Na2CO3+2H2O羰基硫的脱硫常用两种方法,其反应式分别为:①氢解反应:COS(g)+H2(g)═H2S(g)+CO(g)△H1=+7kJ/mol
②水解反应:COS(g)+H2O(g)═H2S(g)+CO2(g)△H2
已知反应中相关的化学键键能数据如表
| 化学键 | C=O(CO2) | C=O(COS) | C=S | H-S | H-O |
| 键能(kJ/mol) | 803 | 742 | 577 | 339 | 465 |
(3)脱硫处理后的CO和H2在催化剂作用下合成甲醇:CO2(g)+3H 2(g)?CH3OH(g)+H2O(g)△H2=-90.14kJ/mol,该反应能自发的理由是该反应是焓减、熵减反应,低温时自发.
①一定温度下,在两个容积都为VL的恒容密闭容器中,找如下方式反应物,一段时间后达到平衡
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | mmolCO2、3mmolH2、 nmolCH3OH(g)、nmolH2O(g) |
②甲容器保持恒容,欲增大H2的平衡转化率,可采取的措施有增大CO的投入量、分离出甲醇、适当降温(答两点即可).
分析 (1)原电池的负极发生氧化反应,导电的是熔融碳酸盐,CO32-向负极移动,据此书写负极电极反应式;
(2)羰基硫分子与二氧化碳分子结构相似,均为直线型;羰基硫与烧碱溶液反应生成两种正盐外,还有水生成,由元素守恒可知,生成正盐为Na2S、Na2CO3;
水解反应:COS(g)+H2O(g)═H2S(g)+CO2(g)的焓变等于旧键断裂吸收的能量和新键生成释放能量的差;
(3)判断反应能否自发进行的判剧为:△G=△H-T△S,当△G<0时反应能自发进行;
①利用三段式,根据等效平衡的思想可答题设平衡时二氧化碳转化了xmol,
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),
开始1(mol):1 3 0 0
变化1(mol):x 3x x x
平衡1(mol):1-x 3-3x x x
开始2 a 3a n n;
甲中平衡后气体的压强为开始的0.8倍,据此可以计算出甲中各物质的物质的量,结合平衡常数的公式计算平衡常数;
②甲容器保持恒容,欲增大H2的平衡转化率,可以通过温度、改变反应物或生成物的浓度促进平衡正向移动来实现.
解答 解:(1)有电解质熔融液组成的CO和O2的燃料电池,而在负极上放电的是CO,故应为CO失电子结合CO32-生成CO2:负极反应为CO-2e-+CO32-=2CO2,
故答案为:CO-2e-+CO32-=2CO2;
(2)羰基硫分子与二氧化碳分子结构相似,均为直线型,其电子式为 ,羰基硫与烧碱溶液反应水和Na2S、Na2CO3,反应为COS+4NaOH=Na2S+Na2CO3+2H2O,若某反应有4mol电子发生转移,则该反应吸收热量为14kJ,COS(g)+H2O(g)═H2S(g)+CO2(g)的焓变=(742+465×2)-(339+803)=-35kJ/mol;
,羰基硫与烧碱溶液反应水和Na2S、Na2CO3,反应为COS+4NaOH=Na2S+Na2CO3+2H2O,若某反应有4mol电子发生转移,则该反应吸收热量为14kJ,COS(g)+H2O(g)═H2S(g)+CO2(g)的焓变=(742+465×2)-(339+803)=-35kJ/mol;
故答案为: ;COS+4NaOH=Na2S+Na2CO3+2H2O;-35;
;COS+4NaOH=Na2S+Na2CO3+2H2O;-35;
(3)已知CO2(g)+3H 2(g)?CH3OH(g)+H2O(g)的△H2<0、△S>0,根据△G=△H-T△S,低温下△G<0,反应能自发的进行,
故答案为:该反应是焓减、熵减反应,低温时自发;
①设平衡时二氧化碳转化了xmol,
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),
开始1(mol):1 3 0 0
变化1(mol):x 3x x x
平衡1(mol):1-x 3-3x x x
开始2 a 3a n n
则由题意可知:$\frac{x+x+1-x+3-3x}{1+3}$=0.8,解得x=0.4,
根据恒温恒容条件下的等效平衡的思想则有开始1和开始2为完全等效,即a+n=1,要使反应始终向逆向进行,则n>x,故a的范围为0.4<n≤1;
此反应的平衡常数K=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$=$\frac{(\frac{0.4}{V})×(\frac{0.4}{V})}{(\frac{0.6}{V})×(\frac{1.8}{V})^{3}}$=0.046V2;
故答案为:0.4<n≤1;0.046V2;
②对于反应CO2(g)+3H 2(g)?CH3OH(g)+H2O(g)增大CO的投入量、分离出甲醇、适当降温均可使平衡正向移动,使H2的平衡转化率增大,
故答案为:增大CO的投入量、分离出甲醇、适当降温.
点评 本题考查学生焓变的计算、原电池的工作原理知识、化学平衡的计算及影响化学平衡的因素,综合性较强,有一定的难度.

| A. | HCl | B. | Na2O2 | C. | MgO | D. | FeCl2 |
| A. | 由H2(g)、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 | |
| B. | 高压比常压有利于由SO2和氧气合成SO3的反应 | |
| C. | 红棕色的NO2,加压后颜色先变深后变浅 | |
| D. | 黄绿色的氯水光照后颜色变浅 |
| A. | 硫化羰在氧气中完全燃烧后的生成物是CO2和SO2 | |
| B. | C3O2与CO一样可以在氧气中燃烧生成CO2 | |
| C. | COS分子中所有原子都满足8电子稳定结构 | |
| D. | CO、C3O2、CO2都是碳的氧化物,它们互为同素异形体 |
| A. | H2反应速率3 mol•l-1•min-1 | B. | N2反应速率0.3 mol•l-1•s-1 | ||
| C. | H2反应速率0.3mol•l-1•s-1 | D. | NH3反应速率0.4mol•l-1•s-1 |
| A. | C5H10O2 | B. | C5H10O5 | C. | C6H6O | D. | C6H12O6 |
| 干法 | Fe2O3、KNO3、KOH 混合加热共熔生成紫红色 K2FeO4 和 KNO2 等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3和 KClO 反应生成紫红色 K2FeO4溶液 |

回答下列问题:
(1)K2FeO4 中 Fe 的化合价+6;实验室干法制备中选用的仪器是 B
A.蒸发皿 B.铁坩埚 C.氧化铝坩埚 D.陶瓷坩埚
(2)在温度较高时 KOH 与 Cl2 反应生成的是 KClO3,写出在温度较高时 KOH 与 Cl2反应的化学方程式6KOH+3Cl2$\frac{\underline{\;高温\;}}{\;}$KClO3+5KCl+3H2O
(3)在溶液 I 中加入 KOH 固体的目的是 BD
A.使 KClO3 转化为 KClO
B.为下一步反应提供碱性的环境
C.KOH 固体溶解放热,有利于提高反应速率
D.与溶液 I 中过量的 Cl2 继续反应,生成更多的 KClO
(4)向次氯酸钾强碱浓溶液中加入 90%的 Fe(NO3)3,发生反应的离子方程式为:
①Fe3++3OH+═Fe(OH)3
②3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O.
(5)用异丙醇代替蒸馏水洗涤湿产品,除能洗去杂质外,其优点有减少K2FeO4晶体洗涤时产品的损失且产品易干燥.
(6)如何判断 K2FeO4 晶体已经洗涤干净取少量最后一次的洗涤液于试管中,加入硝酸银溶液,无白色沉淀则已被洗净.
(7)高铁酸钾(K2FeO4)作为水处理剂的优点之一是能除去悬浮杂质,配平该反应的离子方程式:
4FeO42-+10H2O═4Fe(OH)3(胶体)+3O2↑+8OH-.
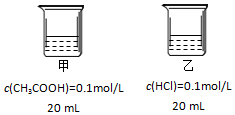
| A. | 甲、乙两烧杯中水电离出的H+浓度:甲<乙 | |
| B. | 分别稀释相同倍数,溶液pH变化:甲=乙 | |
| C. | 相同条件下,AgCl(s)在甲中溶解度大于在乙中 | |
| D. | 向甲烧杯加入NaOH使溶液中性后一定存在:c(Na+)=c(CH3COO-)+c(CH3COOH) |