题目内容
17.某物质 R是人类生命不可缺少的物质.已知 R的摩尔质量为 150g/mol,其中含碳元素 40%,含氢元素 6.7%,其余为氧元素.则 R的化学式为( )| A. | C5H10O2 | B. | C5H10O5 | C. | C6H6O | D. | C6H12O6 |
分析 含碳元素 40%,含氢元素 6.7%,其余为氧元素,则氧元素的含量为1-40%-6.7%=53.3%,又知摩尔质量为 150g/mol,可计算各种元素的质量,计算1mol有机物含有的C、H、O的物质的量,可确定分子式,以此解答该题.
解答 解:含碳元素 40%,含氢元素 6.7%,其余为氧元素,则氧元素的含量为1-40%-6.7%=53.3%,又知摩尔质量为 150g/mol,
则1mol有机物
n(C)=$\frac{150×40}{12}$=5,
n(H)=$\frac{150×6.7%}{1}$=10,
n(O)=$\frac{150×53.3%}{16}$=5,
则分子式为C5H10O5,
故选B.
点评 本题考查有机物分子式的确定,为高频考点,侧重考查学生的分析能力和计算能力,注意把握有机物分子式的确定方法,难度不大.

练习册系列答案
相关题目
7.将过氧化钠投入到FeCl2溶液中,可观察到的实验现象是( )
| A. | 有无色、刺激气味气体产生 | |
| B. | 有白色沉淀生成 | |
| C. | 有红褐色沉淀生成 | |
| D. | 有白色沉淀生成,很快变成灰绿色,最后变为红褐色 |
8.下列说法正确的是( )
| A. | 物质的摩尔质量等于其相对分子(原子)质量 | |
| B. | “物质的量”是国际单位制中的一个基本单位 | |
| C. | 0.012kg 12C中所含的碳原子数为NA | |
| D. | 1 mol任何物质都含有约6.02×1023个原子 |
5.某溶液经分析,其中只含有Na+、K+、Ca2+、Cl-、NO3-,已知其中Na+、K+、Ca2+、NO3-的浓度均为0.1mol•L-1,则Cl-的物质的量浓度为( )
| A. | 0.1mol•L-1 | B. | 0.3mol•L-1 | C. | 0.2mol•L-1 | D. | 0.4mol•L-1 |
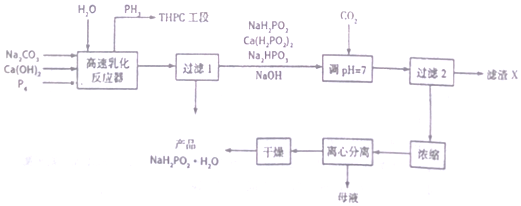
12.煤的气化主要反应是煤中碳与水蒸气反应生成CO、H2等,回答下列问题:
(1)CO和H2分别与O2都可以设计成燃料电池,CO与O2设计成燃料电池(以熔融碳酸盐为电解质)负极的电极反应为CO-2e-+CO32-=2CO2
(2)在煤的气化获得的化工原料气中含有少量羰基硫(COS),能引起催化中毒、大气污染等,COS的电子式为 羰基硫与烧碱溶液反应生成水和两种正盐的离子方程式为COS+4NaOH=Na2S+Na2CO3+2H2O羰基硫的脱硫常用两种方法,其反应式分别为:
羰基硫与烧碱溶液反应生成水和两种正盐的离子方程式为COS+4NaOH=Na2S+Na2CO3+2H2O羰基硫的脱硫常用两种方法,其反应式分别为:
①氢解反应:COS(g)+H2(g)═H2S(g)+CO(g)△H1=+7kJ/mol
②水解反应:COS(g)+H2O(g)═H2S(g)+CO2(g)△H2
已知反应中相关的化学键键能数据如表
则△H2=-35kJ/mol
(3)脱硫处理后的CO和H2在催化剂作用下合成甲醇:CO2(g)+3H 2(g)?CH3OH(g)+H2O(g)△H2=-90.14kJ/mol,该反应能自发的理由是该反应是焓减、熵减反应,低温时自发.
①一定温度下,在两个容积都为VL的恒容密闭容器中,找如下方式反应物,一段时间后达到平衡
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则n的取值范围为0.4<n≤1,反应的平衡常数K=0.046V2.
②甲容器保持恒容,欲增大H2的平衡转化率,可采取的措施有增大CO的投入量、分离出甲醇、适当降温(答两点即可).
(1)CO和H2分别与O2都可以设计成燃料电池,CO与O2设计成燃料电池(以熔融碳酸盐为电解质)负极的电极反应为CO-2e-+CO32-=2CO2
(2)在煤的气化获得的化工原料气中含有少量羰基硫(COS),能引起催化中毒、大气污染等,COS的电子式为
 羰基硫与烧碱溶液反应生成水和两种正盐的离子方程式为COS+4NaOH=Na2S+Na2CO3+2H2O羰基硫的脱硫常用两种方法,其反应式分别为:
羰基硫与烧碱溶液反应生成水和两种正盐的离子方程式为COS+4NaOH=Na2S+Na2CO3+2H2O羰基硫的脱硫常用两种方法,其反应式分别为:①氢解反应:COS(g)+H2(g)═H2S(g)+CO(g)△H1=+7kJ/mol
②水解反应:COS(g)+H2O(g)═H2S(g)+CO2(g)△H2
已知反应中相关的化学键键能数据如表
| 化学键 | C=O(CO2) | C=O(COS) | C=S | H-S | H-O |
| 键能(kJ/mol) | 803 | 742 | 577 | 339 | 465 |
(3)脱硫处理后的CO和H2在催化剂作用下合成甲醇:CO2(g)+3H 2(g)?CH3OH(g)+H2O(g)△H2=-90.14kJ/mol,该反应能自发的理由是该反应是焓减、熵减反应,低温时自发.
①一定温度下,在两个容积都为VL的恒容密闭容器中,找如下方式反应物,一段时间后达到平衡
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | mmolCO2、3mmolH2、 nmolCH3OH(g)、nmolH2O(g) |
②甲容器保持恒容,欲增大H2的平衡转化率,可采取的措施有增大CO的投入量、分离出甲醇、适当降温(答两点即可).
2.下列实验报告记录的实验现象正确的是( )
| 实验 | 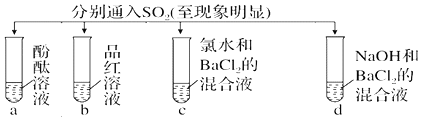 | ||||
| 现象 | A | 无色 | 无色 | 无现象 | 无色溶液 |
| B | 红色 | 无色 | 白色沉淀 | 白色沉淀 | |
| C | 无色 | 无色 | 溶液变无色,白色沉淀 | 白色沉淀 | |
| D | 无色 | 无色 | 无色溶液 | 无色溶液 | |
| A. | A | B. | B | C. | C | D. | D |
6.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,1.12L CCl4含有的共价键数为0.2NA | |
| B. | 常温常压下,2.3g NO2和N2O4的混合物中含有的氧原子数为0.2NA | |
| C. | 过氧化钠与水反应时,生成0.lmol氧气转移的电子数为0.2NA | |
| D. | 常温下,0.1mol•L-1溶液中阴离子总数大于0.1NA |
14.在下列给定条件的溶液中,一定能大量共存的离子组是( )
| A. | 在含有大量[Al(OH)4]-的溶液中:NH4+、Na+、Cl-、H+ | |
| B. | 含有大量Fe3+的溶液中:Na+、Mg2+、I-、SCN- | |
| C. | pH=13的溶液中:K+、NH4+、SO42-、NO3- | |
| D. | 由水电离产生的c(OH-)=1×10-12mol•L-1的溶液中:K+、Na+、Cl-、NO3- |