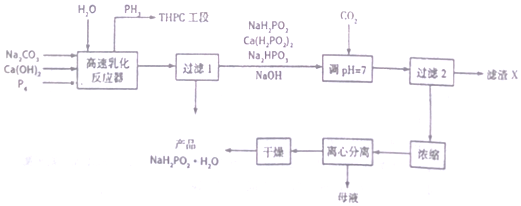
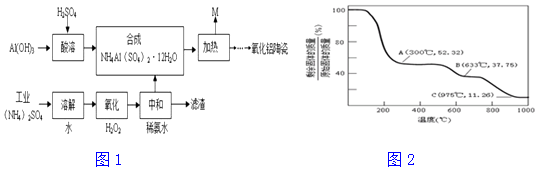
题目内容
1.有机物的组成、结构与性质密切相关.①室内装修产生的主要污染气体有:苯、甲醛及DMF(富马酸二甲酯)等,其中属于烃的是a(填字母).
a.苯 b.甲醛 c.DMF
②下列分子中所有原子可以处于同一平面中的是c(填字母).
a.乙烷 b.溴乙烷c.苯乙烯
③提纯含有少量苯酚的甲苯,适宜的试剂是c(填字母).
a.溴水 b.KMnO4酸性溶液c.NaOH溶液.
分析 (1)甲醛及DMF均含O元素,而烃只含C、H元素;
(2)乙烷、溴乙烷均含甲基,为四面体结构,而苯环、碳碳双键均为平面结构;
(3)苯酚与NaOH反应后,与甲苯分层.
解答 解:(1)甲醛及DMF均含O元素,而烃只含C、H元素,苯只含C、H元素,则苯属于烃,故答案为:a;
(2)乙烷、溴乙烷均含甲基,为四面体结构,则二者所有原子不可能共面,而苯环、碳碳双键均为平面结构,且直接相连,则苯乙烯中所有原子可能共面,故答案为:c;
(3)苯酚与NaOH反应后,与甲苯分层,然后分液可分离,而溴易溶于甲苯、高锰酸钾可氧化甲苯,则提纯含有少量苯酚的甲苯,适宜的试剂是c,故答案为:c.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的组成、结构、性质为解答的关键,侧重分析与应用能力的考查,注意有机物的分离提纯,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.煤的气化主要反应是煤中碳与水蒸气反应生成CO、H2等,回答下列问题:
(1)CO和H2分别与O2都可以设计成燃料电池,CO与O2设计成燃料电池(以熔融碳酸盐为电解质)负极的电极反应为CO-2e-+CO32-=2CO2
(2)在煤的气化获得的化工原料气中含有少量羰基硫(COS),能引起催化中毒、大气污染等,COS的电子式为 羰基硫与烧碱溶液反应生成水和两种正盐的离子方程式为COS+4NaOH=Na2S+Na2CO3+2H2O羰基硫的脱硫常用两种方法,其反应式分别为:
羰基硫与烧碱溶液反应生成水和两种正盐的离子方程式为COS+4NaOH=Na2S+Na2CO3+2H2O羰基硫的脱硫常用两种方法,其反应式分别为:
①氢解反应:COS(g)+H2(g)═H2S(g)+CO(g)△H1=+7kJ/mol
②水解反应:COS(g)+H2O(g)═H2S(g)+CO2(g)△H2
已知反应中相关的化学键键能数据如表
则△H2=-35kJ/mol
(3)脱硫处理后的CO和H2在催化剂作用下合成甲醇:CO2(g)+3H 2(g)?CH3OH(g)+H2O(g)△H2=-90.14kJ/mol,该反应能自发的理由是该反应是焓减、熵减反应,低温时自发.
①一定温度下,在两个容积都为VL的恒容密闭容器中,找如下方式反应物,一段时间后达到平衡
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则n的取值范围为0.4<n≤1,反应的平衡常数K=0.046V2.
②甲容器保持恒容,欲增大H2的平衡转化率,可采取的措施有增大CO的投入量、分离出甲醇、适当降温(答两点即可).
(1)CO和H2分别与O2都可以设计成燃料电池,CO与O2设计成燃料电池(以熔融碳酸盐为电解质)负极的电极反应为CO-2e-+CO32-=2CO2
(2)在煤的气化获得的化工原料气中含有少量羰基硫(COS),能引起催化中毒、大气污染等,COS的电子式为
 羰基硫与烧碱溶液反应生成水和两种正盐的离子方程式为COS+4NaOH=Na2S+Na2CO3+2H2O羰基硫的脱硫常用两种方法,其反应式分别为:
羰基硫与烧碱溶液反应生成水和两种正盐的离子方程式为COS+4NaOH=Na2S+Na2CO3+2H2O羰基硫的脱硫常用两种方法,其反应式分别为:①氢解反应:COS(g)+H2(g)═H2S(g)+CO(g)△H1=+7kJ/mol
②水解反应:COS(g)+H2O(g)═H2S(g)+CO2(g)△H2
已知反应中相关的化学键键能数据如表
| 化学键 | C=O(CO2) | C=O(COS) | C=S | H-S | H-O |
| 键能(kJ/mol) | 803 | 742 | 577 | 339 | 465 |
(3)脱硫处理后的CO和H2在催化剂作用下合成甲醇:CO2(g)+3H 2(g)?CH3OH(g)+H2O(g)△H2=-90.14kJ/mol,该反应能自发的理由是该反应是焓减、熵减反应,低温时自发.
①一定温度下,在两个容积都为VL的恒容密闭容器中,找如下方式反应物,一段时间后达到平衡
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | mmolCO2、3mmolH2、 nmolCH3OH(g)、nmolH2O(g) |
②甲容器保持恒容,欲增大H2的平衡转化率,可采取的措施有增大CO的投入量、分离出甲醇、适当降温(答两点即可).
6.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,1.12L CCl4含有的共价键数为0.2NA | |
| B. | 常温常压下,2.3g NO2和N2O4的混合物中含有的氧原子数为0.2NA | |
| C. | 过氧化钠与水反应时,生成0.lmol氧气转移的电子数为0.2NA | |
| D. | 常温下,0.1mol•L-1溶液中阴离子总数大于0.1NA |
13.下列容器不能用来盛放冷的浓硫酸和浓硝酸的是( )
| A. | 铁制容器 | B. | 铝制容器 | C. | 铜制容器 | D. | 玻璃容器 |
17.由分类思想,下列说法正确的是( )
| A. | 氢氧化钠、盐酸都为强电解质 | |
| B. | 铁生锈、食物腐败都有氧化反应发生 | |
| C. | 糖类、蛋白质都为高分子化合物 | |
| D. | 一氧化碳和二氧化碳都是酸性氧化物 |
18.MnO2和Zn是制造干电池的重要原料,工业上用软锰矿和闪锌矿联合生产MnO2和Zn的基本步骤为:
(1)软锰矿、闪锌矿与硫酸共热:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O
(2)除去反应混合物中的不溶物
(3)电解混合液MnSO4+ZnSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$MnO2+Zn+2H2SO4
下列说法不正确的是( )
(1)软锰矿、闪锌矿与硫酸共热:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O
(2)除去反应混合物中的不溶物
(3)电解混合液MnSO4+ZnSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$MnO2+Zn+2H2SO4
下列说法不正确的是( )
| A. | ①中MnO2和H2SO4都是氧化剂 | B. | 硫酸在该生产中可循环使用 | ||
| C. | ①中析出16gS时转移1mol电子 | D. | ②中MnSO4发生氧化反应 |