题目内容
8.关于碱金属的叙述不正确的是( )| A. | 熔点:Li>Na>K>Rb>Cs | |
| B. | 碱性:LiOH<NaOH<KOH<RbOH<CsOH | |
| C. | 与水反应的剧烈程度:Li<Na<K<Rb<Cs | |
| D. | 都能在空气中燃烧生成R2O(R表示碱金属) |
分析 A.碱金属熔沸点依次降低;
B.元素的金属性越强,对应形成碱的碱性越强;
C.碱金属,从上到下单质活泼性依次增强;
D.锂的氧化物只有氧化锂,钠、钾燃烧生成过氧化物、超氧化物;
解答 解:A.碱金属原子半径依次增大,单质熔沸点依次降低,熔点:Li>Na>K>Rb>Cs,故A正确;
B.碱金属元素的金属性越强形成碱的碱性越强,从上到下形成碱的碱性依次增强,故B正确;
C.碱金属从上到下单质活泼性依次增强,单质活泼性越强,与水反应越剧烈,与水反应的剧烈程度:Li<Na<K<Rb<Cs,故C正确;
D.Li 在氧气中燃烧只生成Li2O,钠、钾等碱金属燃烧生成过氧化物、超氧化物,故D错误;
故选D.
点评 本题考查了碱金属性质,熟悉同主族元素性质的递变规律是解题关键,题目难度不大.

练习册系列答案
 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
18.历史上最早应用的还原性染料是靛蓝,其结构简式如图所示,下列关于靛蓝的叙述中错误的是( )

| A. | 靛蓝由碳、氢、氧、氮四种元素组成 | B. | 它的分子式是C12H10N2O2 | ||
| C. | 该物质是高分子化合物 | D. | 它是不饱和的有机物 |
19.Na和Na+两种粒子中,不相同的是( )
①核内质子数
②最内层电子数
③最外层电子数
④核外电子层数.
①核内质子数
②最内层电子数
③最外层电子数
④核外电子层数.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②③④ |
16.800℃时,a、b、c三种气态物的浓度随时间变化的情况如图,由图分析不能得出的结论是( )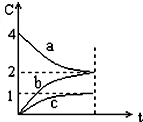

| A. | a是反应物 | B. | 正反应是一个体积扩大的反应 | ||
| C. | 正反应是放热反应 | D. | 若增大压强,平衡逆向移动 |
20.将电解质分为强、弱电解质的依据是( )
| A. | 在一定条件下的电离程度 | B. | 属于离子化合物还是共价化合物 | ||
| C. | 熔融状态下是否完全电离 | D. | 溶于水后的导电能力是强还是弱 |
18.下列化合物中,不能由单质直接化合得到的是( )
| A. | NO | B. | Na2O2 | C. | FeCl2 | D. | CuCl2 |
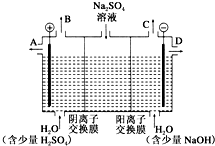 芒硝化学式为Na2SO4•10H2O,无色晶体,易溶于水,是一种分布很广泛的硫酸盐矿物.该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念.
芒硝化学式为Na2SO4•10H2O,无色晶体,易溶于水,是一种分布很广泛的硫酸盐矿物.该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念. .
. .
.