题目内容
 氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.
氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.(1)N2H4中的N原子可达到8电子的稳定结构,画出N2H4的结构式
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为:
(3)肼--空气燃料电池是一种碱性电池,该电池放电时,负极的反应式
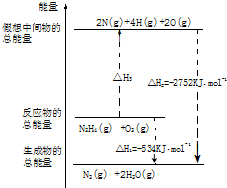
(4)肼是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂1mol化学键所需的能量(kJ):
N≡N为942,O=O为500,N-N为154,则断裂1molN-H键所需的能量是
考点:反应热和焓变,化学电源新型电池
专题:
分析:(1)氮原子最外层电子数为3,易形成3个共价键分析形成8电子结构,依据结构式书写方法写出;
(2)NH3与NaClO反应生成肼(N2H4)、氯化钠和水;
(3)燃料电池,燃料在负极失电子发生氧化反应;
(4)反应的焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量,结合图象计算解答.
(2)NH3与NaClO反应生成肼(N2H4)、氯化钠和水;
(3)燃料电池,燃料在负极失电子发生氧化反应;
(4)反应的焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量,结合图象计算解答.
解答:
解:(1)N2H4中的N原子可达到8电子的稳定结构,氮原子最外层3个电子形成三对共用电子对,和未成键的一对电子形成8电子稳定结构,每个氮原子和两个氢原子形成共价键,氮原子间形成一个共价键,结构式为: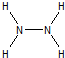 ;
;
故答案为: ;
;
(2)NH3与NaClO反应生成肼(N2H4)、氯化钠和水,依据氧化还原反应得失电子守恒以及原子个数守恒,其方程式为:2NH3+NaClO=N2 H4+NaCl+H2O;
故答案为:2NH3+NaClO=N2H4+NaCl+H2O;
(3)肼--空气燃料电池是一种碱性电池,肼为燃料在负极失去电子,发生氧化反应,电极反应式为:
N2H4-4e-+4OH-=N2+4H2O;
故答案为:N2H4-4e-+4OH-=N2+4H2O;
(4)依据图象分析,反应为N2H4+O2=N2+2H2O,反应的焓变△H=-534KJ/mol,反应的焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量,设断裂1molN-H键吸收的能量为x,断裂化学键吸收的能量=2752-534=2218,形成新键释放的能量=4x+154+500=2752-534,解得:x=391,
故答案为:391.
 ;
; 故答案为:
 ;
;(2)NH3与NaClO反应生成肼(N2H4)、氯化钠和水,依据氧化还原反应得失电子守恒以及原子个数守恒,其方程式为:2NH3+NaClO=N2 H4+NaCl+H2O;
故答案为:2NH3+NaClO=N2H4+NaCl+H2O;
(3)肼--空气燃料电池是一种碱性电池,肼为燃料在负极失去电子,发生氧化反应,电极反应式为:
N2H4-4e-+4OH-=N2+4H2O;
故答案为:N2H4-4e-+4OH-=N2+4H2O;
(4)依据图象分析,反应为N2H4+O2=N2+2H2O,反应的焓变△H=-534KJ/mol,反应的焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量,设断裂1molN-H键吸收的能量为x,断裂化学键吸收的能量=2752-534=2218,形成新键释放的能量=4x+154+500=2752-534,解得:x=391,
故答案为:391.
点评:本题考查了物质结构式的书写、燃料电池的电极反应式的书写,反应热的计算,题目难度中等,明确物质的结构、燃料电池工作原理、焓变计算方法是解题关键.

练习册系列答案
相关题目
水是人类赖以生存的重要物质,水污染却严重影响着人类的生存环境.目前,水污染主要来自 ( )
①工业生产中废渣、废液的任意排放
②农业生产中农药、化肥的过量使用
③城市生活污水的任意排放
④生活垃圾和废旧电池的随意丢弃.
①工业生产中废渣、废液的任意排放
②农业生产中农药、化肥的过量使用
③城市生活污水的任意排放
④生活垃圾和废旧电池的随意丢弃.
| A、①② | B、②③④ |
| C、①③④ | D、①②③④ |
NA为阿伏伽德罗常数的值.下列叙述正确的是( )
| A、常温常压下,8gO2和O3的混合物含有2AA个电子 |
| B、29gC4H10中含有的共价键个数为13NA |
| C、1L1 moI?L-1的NaClO溶液中含有ClO的数日为NA |
| D、标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.2NA |
下列电离方程式正确的是( )
| A、CuCl2═Cu2++Cl2- |
| B、Al2(SO4)3=2Al3++3SO42- |
| C、Fe2(SO4)3═2Fe2++3SO42- |
| D、Ba(NO3)2═Ba2++2(NO3)2- |
染料敏化太阳能电池(简称DSC)工作时类似叶绿素的染料吸收太阳光,产生电子,电子再被电极收集,然后通过外电路,回到反电极产生光电流.该过程中的能量转化形式为( )
| A、太阳能→电能 |
| B、太阳能→化学能 |
| C、化学能→电能 |
| D、电能→化学能 |
为了防止FeSO4被氧化而变质,实验室在配制FeSO4溶液时,常在溶液中加入少量的( )
| A、铜粉 |
| B、铁粉 |
| C、锌粉 |
| D、Fe3(SO4)3 |