题目内容
A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图为: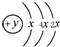 ,B、C可形成离子化合物B3C2,据此填空:
,B、C可形成离子化合物B3C2,据此填空:
(1)A的元素名称为 ,其在周期表中的位置为 .
(2)A、B、C、D四种元素的原子,半径由小到大的顺序为 .(用元素符号表示)
(3)A、C和D的最高价氧化物的水化物中酸性最弱的是 .(填写化学式)
(4)B3C2与水反应的化学方程式 .
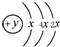 ,B、C可形成离子化合物B3C2,据此填空:
,B、C可形成离子化合物B3C2,据此填空:(1)A的元素名称为
(2)A、B、C、D四种元素的原子,半径由小到大的顺序为
(3)A、C和D的最高价氧化物的水化物中酸性最弱的是
(4)B3C2与水反应的化学方程式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:第一电子层容纳2个电子,故x=2,则A的电子排布是2、8、4,为硅(Si);BC可形成离子化合物B3C2,B为金属,C为非金属,由化合物B3C2可知B显+2价,C显-3价,原子序数A>B,则B为Mg,C为N,C、D同主族,则D为P,据此解答.
解答:
解:第一电子层容纳2个电子,故x=2,则A的电子排布是2、8、4,为硅(Si);BC可形成离子化合物B3C2,B为金属,C为非金属,由化合物B3C2可知B显+2价,C显-3价,原子序数A>B,则B为Mg,C为N,C、D同主族,则D为P,
(1)A为Si元素,在周期表中第3周期ⅣA族,故答案为:硅;第3周期ⅣA族;
(2)同周期自左而右原子半径增大,同主族自上而下原子半径增大,则原子半径N<P<Si<Mg,故答案为:N<P<Si<Mg;
(3)元素的非金属性越弱,对应的最高价氧化物的水化物的酸就越弱,由于在N、P、Si中非金属性最弱的是Si,所以在N、P、Si的最高价氧化物的水化物中酸性最弱的是H2SiO3或 H4SiO4,
故答案为:H2SiO3或 H4SiO4;
(3)B3C2为Mg3N2,与水反应的化学方程式为Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑,故答案为:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑.
(1)A为Si元素,在周期表中第3周期ⅣA族,故答案为:硅;第3周期ⅣA族;
(2)同周期自左而右原子半径增大,同主族自上而下原子半径增大,则原子半径N<P<Si<Mg,故答案为:N<P<Si<Mg;
(3)元素的非金属性越弱,对应的最高价氧化物的水化物的酸就越弱,由于在N、P、Si中非金属性最弱的是Si,所以在N、P、Si的最高价氧化物的水化物中酸性最弱的是H2SiO3或 H4SiO4,
故答案为:H2SiO3或 H4SiO4;
(3)B3C2为Mg3N2,与水反应的化学方程式为Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑,故答案为:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑.
点评:本题考查位置结构性质的相互关系,题目难度中等,注意根据化合物B3C2判断元素的化合价并根据原子序数关系判断元素的种类.

练习册系列答案
相关题目
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法正确的是( )
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法正确的是( )| A、化合物YZ4比化合物XZ熔点高 |
| B、W与X,W与Z均能形成某种具有漂白性的化合物,但原理不同 |
| C、化合物X2YW3既含离子键,又含共价键,可做粘胶剂和防火剂 |
| D、Y的氧化物与Z的氢化物、X的最高价氧化物对应的水化物的溶液均能反应 |
下列电离方程式正确的是( )
| A、CuCl2═Cu2++Cl2- |
| B、Al2(SO4)3=2Al3++3SO42- |
| C、Fe2(SO4)3═2Fe2++3SO42- |
| D、Ba(NO3)2═Ba2++2(NO3)2- |
为了防止FeSO4被氧化而变质,实验室在配制FeSO4溶液时,常在溶液中加入少量的( )
| A、铜粉 |
| B、铁粉 |
| C、锌粉 |
| D、Fe3(SO4)3 |
分类是学习和研究化学的一种重要方法,下列分类合理的是( )
| A、H2SO4和NaHSO4都属于酸 |
| B、K2CO3和K2S都属于盐 |
| C、KOH和Na2CO3都属于碱 |
| D、Na2O和Na2SiO3都属于氧化物 |
