题目内容
9.下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
 .
.(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4;碱性最强的化合物的名称是KOH.
(3)最高价氧化物是两性氧化物的元素是Al;写出它的氧化物与氢氧化钠反应的化学方程式Al2O3+2OH-=2AlO2-+H2O.
(4)元素④与⑦的化合物属于离子(填“共价”或“离子”)化合物.
分析 由元素在周期表中的位置可知,①为C、②为N、③为O、④为Na、⑤为Al、⑥为S、⑦为Cl、⑧为Ar、⑨为K.
(1)稀有气体最外层为稳定结构,化学性质最不活泼;
(2)在最高价氧化物的水化物中,酸性最强的是高氯酸;K的金属性最强,最高价氧化物的水化物中,碱性最强的化合物为KOH;
(3)氧化铝属于两性氧化物,与氢氧化钠反应生成偏铝酸钠与水;
(4)元素④与⑦的化合物为NaCl,由钠离子与氯离子构成.
解答 解:由元素在周期表中的位置可知,①为C、②为N、③为O、④为Na、⑤为Al、⑥为S、⑦为Cl、⑧为Ar、⑨为K.
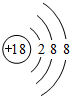
(1)在这些元素中,化学性质最不活泼的是:Ar,原子结构示意图为 ,
,
故答案为:Ar; ;
;
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4;碱性最强的化合物的名称是KOH,
故答案为为:HClO4;KOH;
(3)最高价氧化物是两性氧化物的元素是Al;氧化铝与氢氧化钠反应的化学方程式:Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al;Al2O3+2OH-=2AlO2-+H2O;
(4)元素④与⑦的化合物为NaCl,由钠离子与氯离子构成,属于离子化合物,
故答案为:离子.
点评 本题考查学生元素周期律和元素周期表的综合应用,侧重常用化学用语、元素周期律的考查,难度不大,注意基础知识的理解掌握.

练习册系列答案
相关题目
20.在5L的密闭容器中,一定条件下发生化学反应:2NO(g)+2CO(g)?N2(g)+2CO2(g).起始反应时NO和CO各为3mol,保持密闭容器体积不变,10秒钟达到化学平衡,测得N2为1mol.下列有关反应速率的说法中,正确的是( )
| A. | 达到平衡后,若将容器体积压缩为2 L,则正反应速率将增大,逆反应速率将减小 | |
| B. | 反应前5秒钟内,用CO表示的平均反应速率为0.04 mol•L-1•s-1 | |
| C. | 当v正(CO)=2v逆(N2)时,该反应中NO的物质的量不再改变 | |
| D. | 保持压强不变,往容器中充入1 mol He,正、逆反应速率都不改变 |
17.标准状况下1mol烃完全燃烧时,生成89.6L CO2,又知0.1mol此烃能与标准状况下4.48L H2加成,则此烃的结构简式是( )
| A. | CH3CH2CH2CH3 | B. | CH3-C≡C-CH3 | ||
| C. | CH3CH2CH═CH2 | D. | CH2═CH-CH═CH-CH3 |
4.石油是一种重要能源,人类正面临着石油短缺、油价上涨的困惑.以下解决能源问题的方法不当的是( )
| A. | 用木材作燃料 | B. | 用乙醇替代汽油 | C. | 开发风能 | D. | 开发地热 |
14.能说明苯环对羟基有影响,使羟基变得活泼的事实是( )
| A. | 苯酚能和溴水迅速反应 | B. | 苯酚具有极弱酸性 | ||
| C. | 室温时苯酚不易溶解于水 | D. | 液态苯酚能与钠反应放出氢气 |
19.几种短周期元素的原子半径及主要化合价如表所示,下列说法正确的是( )
| 元素代号 | X | Y | Z | M | R |
| 原子半径(×10-10m) | 1.60 | 1.86 | 0.75 | 0.74 | 1.02 |
| 主要化合价 | +2 | +1 | +5,-3 | -2 | +6,-2 |
| A. | Z的最高价氧化物对应的水化物与其最简单氢化物反应生成的化合物中含离子键和极性键 | |
| B. | 最简单氢化物的稳定性:Z>M | |
| C. | 最简单氢化物的沸点高低顺序为:R>M | |
| D. | 最高价氧化物对应水化物的碱性强弱顺序为:X>Y |
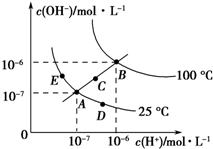 已知水的电离平衡曲线如图所示,试回答下列问题:
已知水的电离平衡曲线如图所示,试回答下列问题:
 ,该反应用于苯酚的定性检验和定量测定.
,该反应用于苯酚的定性检验和定量测定.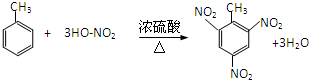 .
.
 ,C
,C .
.