题目内容
20.在5L的密闭容器中,一定条件下发生化学反应:2NO(g)+2CO(g)?N2(g)+2CO2(g).起始反应时NO和CO各为3mol,保持密闭容器体积不变,10秒钟达到化学平衡,测得N2为1mol.下列有关反应速率的说法中,正确的是( )| A. | 达到平衡后,若将容器体积压缩为2 L,则正反应速率将增大,逆反应速率将减小 | |
| B. | 反应前5秒钟内,用CO表示的平均反应速率为0.04 mol•L-1•s-1 | |
| C. | 当v正(CO)=2v逆(N2)时,该反应中NO的物质的量不再改变 | |
| D. | 保持压强不变,往容器中充入1 mol He,正、逆反应速率都不改变 |
分析 A、压强增大正逆反应速率都增大;
B、根据v=$\frac{△c}{△t}$计算前10s内v(N2),再利用速率之比等于化学计量数之比计算前10s内v(CO);
C、可逆反应达平衡时,用不同物质表示正、逆速率之比等于化学计量数之比;
D、保持压强不变,往容器中充入1 mol He,各组分浓度减小.
解答 解:A、达到平衡后,若将容器体积压缩为2 L,压强增大,各组分浓度增大,正逆反应速率都增大,故A错误;
B、v(N2)=$\frac{△c}{△t}$=$\frac{\frac{1mol}{5L}}{10s}$=0.02mol/(L•s),所以v(CO)=2×0.02mol/(L•s)=0.04mol/(L•s),所以反应前5秒钟内,用CO表示的平均反应速率大于0.04 mol•L-1•s-1,故B错误;
C、v正(CO)=2v逆(N2),说明正逆反应速率相等,反应达到平衡状态,各组分浓度不再变化.故C正确;
D、保持压强不变,往容器中充入1 mol He,各组分浓度减小,正逆反应速率都减小,故D错误;
故选C.
点评 本题考查化学反应速率计算与影响因素、化学平衡状态判定、影响化学平衡的因素等,难度中等,注意D中,开始反应物的浓度减小,反应速率减慢.

练习册系列答案
相关题目
10.已知同周期的X、Y、Z三种元素的最高价氧化物的水化物,其酸性由强到弱的顺序为 HZO4>H2YO4>H3XO4,判断下列叙述正确的是( )
| A. | 原子半径按X、Y、Z的顺序增大 | |
| B. | 单质的氧化性按X、Y、Z的顺序减弱 | |
| C. | 元素的非金属性按X、Y、Z的顺序增强 | |
| D. | 气态氢化物稳定性按X、Y、Z的顺序减弱 |
11.下列各组顺序的排列不正确的是( )
| A. | 离子半径:Na+>Mg2+>Al3+>F- | B. | 热稳定性:HCl>H2S>PH3>AsH3 | ||
| C. | 酸性强弱:H2SiO3<H2CO3<H3PO4 | D. | 熔点:SiO2>NaCl>I2>CO2 |
15.如表列出了A~R十二种元素在周期表中的位置:
请用相应的化学符号和化学用语回答下列问题:
(1)其中单质化学性质最不活泼的元素是Ar,最活泼的金属元素是K;
(2)A、C、D三种元素的氧化物对应的水化物,其中碱性最强的是NaOH;其中J与F按原子个数1:1所成的化合物的电子式为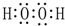 .
.
(3)A、B、C三种元素按离子半径由大到小的顺序排列为K+>Na+>Mg2+;
(4)元素G的气态氢化物比元素H的气态氢化物稳定(填“稳定”或“不稳定”).元素K和I的气态氢化物沸点较高的是NH3(填化学式).其原因是氨气分子之间存在氢键.
(5)元素G的单质溶于元素A的最高价氧化物对应的水化物中,可生成具有漂白作用的一种盐,该盐的化学式为NaClO,该化合物中所含的化学键类型为离子键、共价键.
(6)元素B、C、D的简单阳离子的氧化性比较Al3+>Mg2+>Na+.(填离子符号)
(7)1g元素J的单质完全燃烧生成液态氧化物时放出的热量为142.9KJ,写出元素J的单质燃烧热的热化学方程式:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1 .
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 1 | J | |||||||
| 2 | E | K | F | |||||
| 3 | A | C | D | I | G | R | ||
| 4 | B | H |
(1)其中单质化学性质最不活泼的元素是Ar,最活泼的金属元素是K;
(2)A、C、D三种元素的氧化物对应的水化物,其中碱性最强的是NaOH;其中J与F按原子个数1:1所成的化合物的电子式为
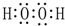 .
.(3)A、B、C三种元素按离子半径由大到小的顺序排列为K+>Na+>Mg2+;
(4)元素G的气态氢化物比元素H的气态氢化物稳定(填“稳定”或“不稳定”).元素K和I的气态氢化物沸点较高的是NH3(填化学式).其原因是氨气分子之间存在氢键.
(5)元素G的单质溶于元素A的最高价氧化物对应的水化物中,可生成具有漂白作用的一种盐,该盐的化学式为NaClO,该化合物中所含的化学键类型为离子键、共价键.
(6)元素B、C、D的简单阳离子的氧化性比较Al3+>Mg2+>Na+.(填离子符号)
(7)1g元素J的单质完全燃烧生成液态氧化物时放出的热量为142.9KJ,写出元素J的单质燃烧热的热化学方程式:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1 .
5.下列有关放热反应、吸热反应的说法不正确的是( )
| A. | 吸热反应的发生都需要加热,放热反应在常温下一定容易发生 | |
| B. | 若某反应正向进行时为放热反应,则该反应逆向进行时必为吸热反应 | |
| C. | 由“C(石墨)=C(金刚石)是吸热反应”可知石墨比金刚石稳定 | |
| D. | 不管是吸热反应还是放热反应,升高温度,反应速率均增大 |
12.以锌片和铜片为电极,以稀硫酸为电解质溶液的原电池中,当导线中通过2mol电子时,下列说法正确的是( )
| A. | 锌片溶解了1 mol,铜片上析出1 mol氢气 | |
| B. | 两极溶解和析出的物质的质量相等 | |
| C. | 锌片溶解了1 g,铜片上析出1 g氢气 | |
| D. | 锌片溶解了1 mol,硫酸消耗了2mol |
9.下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填具体元素符号).原子结构示意图为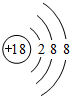 .
.
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4;碱性最强的化合物的名称是KOH.
(3)最高价氧化物是两性氧化物的元素是Al;写出它的氧化物与氢氧化钠反应的化学方程式Al2O3+2OH-=2AlO2-+H2O.
(4)元素④与⑦的化合物属于离子(填“共价”或“离子”)化合物.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
 .
.(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4;碱性最强的化合物的名称是KOH.
(3)最高价氧化物是两性氧化物的元素是Al;写出它的氧化物与氢氧化钠反应的化学方程式Al2O3+2OH-=2AlO2-+H2O.
(4)元素④与⑦的化合物属于离子(填“共价”或“离子”)化合物.
10.A、B、C、D、E 是同一短周期的五种元素,A和B的最高价氧化物对应的水化物呈碱性,且碱性前者强于后者,C和D的最高价氧化物对应的水化物溶液呈酸性,且酸性前者强于后者,五种元素形成的简单离子中,E的离子半径最小,则它们的原子序数由大到小的顺序是( )
| A. | B A D C E | B. | E C D A B | C. | A B E D C | D. | C D E B A |