题目内容
17.标准状况下1mol烃完全燃烧时,生成89.6L CO2,又知0.1mol此烃能与标准状况下4.48L H2加成,则此烃的结构简式是( )| A. | CH3CH2CH2CH3 | B. | CH3-C≡C-CH3 | ||
| C. | CH3CH2CH═CH2 | D. | CH2═CH-CH═CH-CH3 |
分析 根据C原子守恒计算分子中C原子数目,由0.1 mol 该烃可与0.2 mol H2加成可知结构中有一个三键或两个碳碳双键,结合选项判断.
解答 解:由题意知:n(CO2)=$\frac{89.6L}{22.4L/mol}$=4 mol,该烃含4个碳原子,根据碳原子数排除D项,
氢气物质的量为$\frac{4.48L}{22.4L/mol}$=0.2mol,由0.1 mol 该烃可与0.2 mol H2加成可知结构中有一个三键或两个碳碳双键,可排除选项A、C,
选项中只有CH3-C≡C-CH3符合,
故选:B.
点评 本题考查有机物分子式确定,注意对加成反应反应的理解,试题培养了学生分析计算能力,有利于基础知识的巩固.

练习册系列答案
相关题目
7.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | pH=1的溶液:Ag+、Al3+、Cl-、SO42- | |
| B. | 能使甲基橙溶液变红的溶液:Na+、K+、HCO3-、S2- | |
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=10-12的溶液:NH4+、Cu2+、NO3-、Cl- | |
| D. | 无色溶液中:K+、CH3COO-、HCO3-、MnO4- |
5.下列有关放热反应、吸热反应的说法不正确的是( )
| A. | 吸热反应的发生都需要加热,放热反应在常温下一定容易发生 | |
| B. | 若某反应正向进行时为放热反应,则该反应逆向进行时必为吸热反应 | |
| C. | 由“C(石墨)=C(金刚石)是吸热反应”可知石墨比金刚石稳定 | |
| D. | 不管是吸热反应还是放热反应,升高温度,反应速率均增大 |
12.以锌片和铜片为电极,以稀硫酸为电解质溶液的原电池中,当导线中通过2mol电子时,下列说法正确的是( )
| A. | 锌片溶解了1 mol,铜片上析出1 mol氢气 | |
| B. | 两极溶解和析出的物质的质量相等 | |
| C. | 锌片溶解了1 g,铜片上析出1 g氢气 | |
| D. | 锌片溶解了1 mol,硫酸消耗了2mol |
9.下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填具体元素符号).原子结构示意图为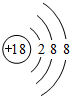 .
.
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4;碱性最强的化合物的名称是KOH.
(3)最高价氧化物是两性氧化物的元素是Al;写出它的氧化物与氢氧化钠反应的化学方程式Al2O3+2OH-=2AlO2-+H2O.
(4)元素④与⑦的化合物属于离子(填“共价”或“离子”)化合物.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
 .
.(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4;碱性最强的化合物的名称是KOH.
(3)最高价氧化物是两性氧化物的元素是Al;写出它的氧化物与氢氧化钠反应的化学方程式Al2O3+2OH-=2AlO2-+H2O.
(4)元素④与⑦的化合物属于离子(填“共价”或“离子”)化合物.
 CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.
CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.
 :2,2,4三甲基-戊烷;
:2,2,4三甲基-戊烷; :间甲基苯乙烯.
:间甲基苯乙烯.